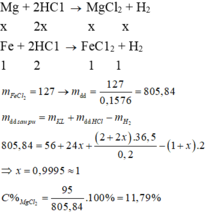Hoà tan hoàn toàn hỗn hợp X foomf Fe và Mg bằng 1 lượng vừa đủ dd HCl 20% thu được dd Y. Nồng độ % FeCl2 trong dd Y là 15,76%. Tính thể tích khí H2 thu đượcr đkc và nồng độ % MgCl2 trong dd Y

Những câu hỏi liên quan
Hoà tan hoàn toàn hh X gồm Fe và Mg bằng một lượng vừa đủ dd HCl 20%, thu đươc dd Y. Nồng độ của FeCl2 trong dd Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dd Y là
A. 24,24%.
B. 11,79%.
C. 28,21%.
D. 15,76%.
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là A. 24,24% B. 11,79% C. 28,21% D. 15,76%
Đọc tiếp
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
A. 24,24%
B. 11,79%
C. 28,21%
D. 15,76%
Đáp án B
Fe+2HCl → FeCl2 + H2
a 2a a a
Mg + 2HCl → MgCl2+H2
b 2b b b
mchất rắn X = 56a + 24b ; mddHCl = 36,5/20% .2.(a + b) = 365(a + b)
![]()
⇒ mddsau pư = 56a + 24b + 365(a + b) – 2(a + b) = 419a + 387b
![]() .100 = 15,76
.100 = 15,76
Giải PT ⇒ a = b ⇒ ![]() .100 = 11,79%
.100 = 11,79%
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của
F
e
C
l
2
trong dung dịch Y là 15,76%. Nồng độ phần trăm của
M
g
C
l
2
trong dung dịch Y là A. 24,24% B. 15,76% C. 28,21% D. 11,79%
Đọc tiếp
Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của F e C l 2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của M g C l 2 trong dung dịch Y là
A. 24,24%
B. 15,76%
C. 28,21%
D. 11,79%
Hòa tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dd HCl 20% thu được dung dịch Y . Biết nồng độ của MgCl2 trong dung dịch Y là 11,87 %
a,Viết phương trình phản ứng .
b,Tính nồng độ % của muối sắt trong dung dịch Y
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
b, Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(\left\{{}\begin{matrix}n_{HCl}=2n_{Fe}+2n_{Mg}=2x+2y\left(mol\right)\\n_{H_2}=n_{Fe}+n_{Mg}=x+y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{HCl}=36,5.\left(2x+2y\right)=73\left(x+y\right)\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{73\left(x+y\right)}{20\%}=365\left(x+y\right)\left(g\right)\)
Ta có: m dd sau pư = mFe + mMg + m dd HCl - mH2 = 56x + 24y + 365.(x+y) - 2.(x+y) = 419x + 387y (g)
Theo PT: \(n_{MgCl_2}=n_{Mg}=y\left(mol\right)\)
\(C\%_{MgCl_2}=11,87\%\) \(\Rightarrow\dfrac{95y}{419x+387y}=0,1187\)
\(\Rightarrow\dfrac{x}{y}=0,9865\Rightarrow x=0,9865y\)
Theo PT: \(n_{FeCl_2}=n_{Fe}=x\left(mol\right)\)
\(\Rightarrow C\%_{FeCl_2}=\dfrac{127x}{419x+387y}.100\%=\dfrac{127.0,9865y}{419.0,9865y+387y}.100\%\approx15,65\%\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ phần trăm của
F
e
C
l
2
trong dung dịch Y là 15,76%. Nồng độ phần trăm của
M
g
C
l
2
trong dung dịch Y là A. 24,24% B. 11,79% C. 28,21% D. 15,76%
Đọc tiếp
Hòa tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ phần trăm của F e C l 2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của M g C l 2 trong dung dịch Y là
A. 24,24%
B. 11,79%
C. 28,21%
D. 15,76%
Chọn đáp án B
L ấ y 1 m o l F e : x m o l M g : x - 1 m o l
F e + 2 H C l → F e C l 2 + H 2 ↑ x 2 x x x
M g + 2 H C l → M g C l 2 + H 2 ↑ 1 - x 2 1 - x 1 - x 1 - x
n H 2 = 1 m o l , n H C l = 2 m o l ⇒ m d d H C l = 2 . 36 , 5 . 100 20 = 365 g m d d Y = 56 x + 24 1 - x + 365 - 1 . 2 = 387 + 32 x
C % F e C l 2 = 127 x 387 + 32 x . 100 % = 15 , 76 % ⇒ x = 0 , 5 m o l ⇒ C % M g C l 2 = 95 . 0 , 5 387 + 32 . 0 , 5 . 100 % = 11 , 79 %
Đúng 0
Bình luận (0)
Hoà tan hoàn toàn 8,3g hỗn hợp X gầm Al,Fe bằng lượng vừa đủ dd HCl 7,3% kết thúc phản ứng thu được dd Y và giải phóng 5.6l H2(đktc) a)Viết PTHH B) Tính % khối lượng kim loại trong hỗn hợp x c)Tính m dd HCl đã dùng d)Tính nồng độ % các chất tan trong dd Y
\(a)2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ b)n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\\ n_{Al}=a;n_{Fe}=b\\ \left\{{}\begin{matrix}3a+b=0,25\\27a+56b=8,3\end{matrix}\right.\\ a=\dfrac{19}{470};b=\dfrac{121}{940}\\ \%m_{Al}=\dfrac{\dfrac{19}{470}\cdot27}{8,3}\cdot100=13,15\%\\ \%m_{Fe}=100-13,15=86,85\%\\ c)n_{HCl}=3\cdot\dfrac{19}{470}+2\cdot\dfrac{121}{940}=\dfrac{89}{235}mol\\ m_{ddHCl=}=\dfrac{\dfrac{89}{235}\cdot36,5}{7,3}\cdot100=189g\\ d)n_{AlCl_3}=n_{Al}=\dfrac{19}{470}mol\\ n_{Fe}=n_{FeCl_2}=\dfrac{121}{940}mol\)
\(m_{dd}=8,3+189-0,25.2=196,8g\\ C_{\%AlCl_3}=\dfrac{\dfrac{19}{470}\cdot133,8}{196,8}\cdot100=2,8\%\\ C_{\%FeCl_2}=\dfrac{\dfrac{121}{940}127}{196,8}\cdot100=8,3\%\)
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng 1 lượng vừa đủ dd HCl 20% thu được dd Y. C% FeCl2 trong dd Y là 15,76%. Tính C% MgCl2 trong dd Y
1. Khi hòa tan một hỗn hợp 14.5 gam (Fe, Zn, Mg) bằng dd HCl vừa đủ thì thu được dd X có chứa 35.8 gam muối. Vậy thể tích dd NaOH 1M đủ để kết tủa hết các ion kim loại trong dd X là bao nhiêu?
2. Cho 4.6 gam Na vào dd HCl thu được dd X chứa 9.85 gam chất tan. Tính khối lượng kết tủa thu được khi cho dd X vào dd AgNO3 dư
3. Cho 12.1 gam hỗn hợp X gồm zn và fe vào 100 ml dd hcl thấy còn 3.36 gam chất rắn không tan. Nếu cho 12.1 gam chất rắn đó vào 200 ml dd hcl thì kim loại tan hết. Cô cạn dd thu...
Đọc tiếp
1. Khi hòa tan một hỗn hợp 14.5 gam (Fe, Zn, Mg) bằng dd HCl vừa đủ thì thu được dd X có chứa 35.8 gam muối. Vậy thể tích dd NaOH 1M đủ để kết tủa hết các ion kim loại trong dd X là bao nhiêu?
2. Cho 4.6 gam Na vào dd HCl thu được dd X chứa 9.85 gam chất tan. Tính khối lượng kết tủa thu được khi cho dd X vào dd AgNO3 dư
3. Cho 12.1 gam hỗn hợp X gồm zn và fe vào 100 ml dd hcl thấy còn 3.36 gam chất rắn không tan. Nếu cho 12.1 gam chất rắn đó vào 200 ml dd hcl thì kim loại tan hết. Cô cạn dd thu được 26.3 gam chất rắn khan
a) Xác định khối lượng của Fe trong hỗn hợp X
b) Tính nồng độ mol/l của dd hcl
4. Hoà tan hoàn toàn hỗn hợp X gồm fe và mg bằng một lượng vừa đủ dd hcl 20%, thu được dd Y. Nồng độ của Fecl2 trong dd Y là 15.76%. nồng độ % của Mgcl2 trong dd Y là bao nhiêu?
hòa tan hoàn toàn 14g fe trong 100ml HCl a M vừa đủ thu được dd X vừa đủ và V lít khí H2 (đkc).
a, xd giá trih của V và a.
b, cho 400 ml đ vào AgNO3 1.3M vào dd X thu được m gam chất rắn và dd Y. tính m và nồng độ mol các chất có trong dd Y
GIÚP EM VỚI ẠAAAAAA
a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Ta có: \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{HCl}=2n_{Fe}=0,5\left(mol\right)\\n_{H_2}=n_{Fe}=0,25\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow V_{H_2}=0,25.24,79=6,1975\left(l\right)\)
\(a=C_{M_{HCl}}=\dfrac{0,5}{0,1}=5\left(M\right)\)
b, Theo PT: \(n_{FeCl_2}=n_{Fe}=0,25\left(mol\right)\)
Ta có: \(n_{AgNO_3}=0,4.1,3=0,52\left(mol\right)\)
PT: \(2AgNO_3+FeCl_2\rightarrow Fe\left(NO_3\right)_2+2AgCl_{\downarrow}\)
______0,5______0,25______0,25________0,5 (mol)
\(AgNO_3+Fe\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_3+Ag_{\downarrow}\)
0,02______0,02________0,02________0,02 (mol)
⇒ m = mAgCl + mAg = 0,5.143,5 + 0,02.108 = 73,91 (g)
- Dd sau pư gồm: Fe(NO3)3: 0,02 (mol) và Fe(NO3)2: 0,25 - 0,02 = 0,23 (mol)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Fe\left(NO_3\right)_3}}=\dfrac{0,02}{0,1+0,4}=0,04\left(M\right)\\C_{M_{Fe\left(NO_3\right)_2}}=\dfrac{0,23}{0,1+0,4}=0,46\left(M\right)\end{matrix}\right.\)
Đúng 1
Bình luận (0)
\(Fe+2HCl->FeCl_2+H_2\\ a.V=\dfrac{14}{56}\cdot22,4=5,6\left(L\right)\\ a=\dfrac{\dfrac{14}{56}\cdot2}{0,1}=5\left(M\right)\\ b.n_{AgNO_3}=0,4\cdot1,3=0,52mol\\ FeCl_2+AgNO_3->Fe\left(NO_3\right)_2+AgCl\\ Fe\left(NO_3\right)_2+AgNO_3->Ag+Fe\left(NO_3\right)_3\\ m=0,25\cdot143,5+0,25\cdot108=62,875\left(g\right)\\ C_{M\left(AgNO_3\right)}=\dfrac{0,02}{0,5}=0,04M\\ C_{M\left(Fe\left(NO_3\right)_3\right)}=\dfrac{0,25}{0,5}=0,5M\)
Đúng 0
Bình luận (0)