Cho 48 gam Fe2O3 vào dung dịch HNO3 12,6% vừa đủ. Tính nồng độ phần trăm dung dịch thu được
Hòa tan hoàn toàn hỗn hợp gồm Fe,FeO,Fe2O3 và Fe3O4 vào 63g dung dịch HNO3 thì thu được 0,336 lít khí NO (đktc, duy nhất). Cho dung dịch sau phản ứng tác dụng vừa đủ với 450ml dung dịch NaOH 1M thu được kết tủa lớn nhất. Lọc kết tủa nung đến khối lượng không đổi thu được 8,0 gam chất rắn. Nồng độ phần trăm của dung dịch HNO3 là bao nhiêu?
Câu 10: Cho 11,2g Fe tác dụng vừa đủ với 200 gam dung dịch HNO3 loãng thu được V lít dung dịch NO (sản phẩm khử duy nhất ở đktc).
a. Tính giá trị V?
b. Tính nồng độ phần trăm dung dịch HNO3 đã dùng?
a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Mol: 0,2 0,8 0,2
\(V_{NO}=0,2.22,4=4,48\left(l\right)\)
b, \(C\%_{ddHNO_3}=\dfrac{0,8.63.100\%}{200}=25,2\%\)
cho 11,2 gam sắt tác dụng vừa đủ với 200 gam dung dịch HCL. a) tính nồng độ phần trăm của dung dịch HCL. b) tính nồng độ phần trăm của dung dịch muối thu được sau phản ứng?
a) $n_{Fe} = \dfrac{11,2}{56} = 0,2(mol)$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{HCl} =2 n_{Fe} = 0,2.2 = 0,4(mol)$
$C\%_{HCl} = \dfrac{0,4.36,5}{200}.100\% = 7,3\%$
b) $n_{H_2} = n_{FeCl_2} = n_{Fe} = 0,2(mol)
Sau phản ứng, $m_{dd} = 11,2 + 200 - 0,2.2 = 210,8(gam)$
$C\%_{FeCl_2} = \dfrac{0,2.127}{210,8}.100\% = 12,05\%$
cho 29,6 gam hỗn hợp x gồm Fe và Fe2O3 tác dụng hết với dung dịch HNO3 12,6%. sau khi pứ xảy ra hoàn toàn thu đc dung dịch Z và 1,12 lít khí NO(đktc, sản phẩm khử duy nhất).Tính nồng độ phần trăm của các chất trong dung dịch Z.
Các Pro giúp e vs
$Fe + 4HNO_3 \to Fe(NO_3)_3 + NO + 2H_2O$
$Fe_2O_3 + 6HNO_3 \to 2Fe(NO_3)_3 + 3H_2O$
n Fe = n NO = 1,12/22,4 = 0,05(mol)
=> n Fe2O3 = (29,6 - 0,05.56)/160 = 0,1675 mol
n HNO3 = 4n Fe + 6n Fe2O3 = 1,205(mol)
=> m dd HNO3 = 1,205.63/12,6% = 602,5 gam
Sau phản ứng :
n Fe(NO3)3 = n Fe + 2n Fe2O3 = 0,385 mol
m dd = m X + m dd HNO3 - n NO = 29,6 + 602,5 - 0,05.30 = 630,6 gam
=> C% Fe(NO3)3 = 0,385.242/630,6 .100% = 14,77%
HNO3 là axit rất mạnh nên nó oxi hóa kim loại lên số oxi hóa cao nhất
Hòa tan hết 14,6 gam hỗn hợp gồm Zn và ZnO có tỷ lệ mol 1:1 trong 250 gam dung dịch HNO3 12,6% thu được dung dịch X và 0,336 lít khí Y (đktc). Cho từ từ 740 ml dung dịch KOH 1M vào dung dịch X thu được 5,94 gam kết tủa. Nồng độ phần trăm của muối trong dung dịch X là:
A. 28,02%
B. 14,29%
C. 12,37%
D. 14,32%
Định hướng tư duy giải
Ta có:
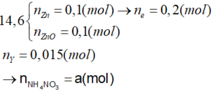
Có NH4NO3 vì nếu Y là N2
→ n e Max = 0 , 15 < 0 , 2 .
Sau khi cho KOH vào thì K nó chạy đi đâu? Việc trả lời CÂU hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
0,74 mol KOH + X
→ BTNT . K n K N O 3 = 0 , 74 - 0 , 14 . 2 = 0 , 46 m o l n K 2 Z n O 2 = 0 , 2 - 0 , 06 = 0 , 14 m o l
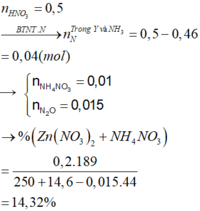
Hòa tan hết 14,6 gam hỗn hợp gồm Zn và ZnO có tỉ lệ mol 1:1 trong 250 gam dung dịch HNO3 12,6% thu được dung dịch X và 0,336 lít khí Y (đktc). Cho từ từ 740ml dung dịch KOH 1M vào dung dịch X thu được 5,94 gam kết tủa. Nồng độ phần trăm của Zn(NO3)2 trong dung dịch X là:
A. 28,02%
B. 14,29%
C. 14,32%
D. 12,37%
Ta có nZn = nZnO = 0,1 mol, nHNO3 = 0,5 mol
Kết tủa thu được là Zn(OH)2: 0,06 mol
Vậy dung dịch sau phản ứng + KOH chứa K2ZnO2: (0,1 + 0,1 - 0,06) = 0,14 mol và KNO3: (0,74 - 2 × 0,14) = 0,46 mol
Bảo toàn nguyên tố N → nN (Y) + nNH4 + = 0,5 - 0,46 = 0,04 mol
Nếu khí Y chứa 1 nguyên tố N (NO và NO2) → nNH4+ = 0,04 - 0,015 = 0,025
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,025×80,015 = 0 (Vô lý)
Vậy khí Y chứa 2 nguyên tố N (N2, N2O) → nNH4+ = 0,04 - 0,015 × 2 = 0,01 mol
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,01×80,015 = 8 → khí tạo thành là N2O
Bảo toàn khối lượng → mdd = 14,6 + 250 - 0,015 × 44 = 263,94 gam
C% Zn(NO3)2 = (0,2×189/ 263,94 )×100% = 14,32%
Đáp án C
Hòa tan hết 14,6 gam hỗn hợp gồm Zn và ZnO có tỷ lệ mol 1:1 trong 250 gam dung dịch HNO3 12,6% thu được dung dịch X và 0,336 lít khí Y (đktc). Cho từ từ 740 ml dung dịch KOH 1M vào dung dịch X thu được 5,94 gam kết tủa; Nồng độ phần trăm của Zn(NO3)2 trong dung dịch X là:
A. 28,02%
B. 14,29%
C. 12,37%
D. 14,32%
Chọn đáp án D
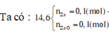


Có NH4NO3 vì nếu Y là N2 ![]()
Sau khi cho KOH vào thì K nó chạy đi đâu?Việc trả lời câu hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
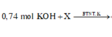

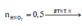
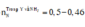
![]()
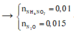
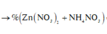
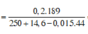
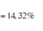
Hoà tan hoàn toàn 10,2 gam Al2O3 vào 200 gam dung dịch H2SO4 loãng vừa đủ.
a/. Tính khối lượng muối thu được sau phản ứng ?
b/. Tính nồng độ phần trăm của dung dịch H2SO4 cần dùng?
c/. Tính nồng độ phần trăm của dung dịch muối tạo thành?
(khối lượng dung dịch sau phản ứng = khối lượng các chất ban đầu)
(Biết Al=27, O=16, H=1, S=32)
Bài 1: Hòa tan hoàn toàn 12,6 gam hỗn hợp Mg và Al vào dung dịch H2SO4 14,7 % (vừa đủ) sau phản ứng thu được 13,44 lít H2 (ở đktc).
1. Tính thành phần phần trăm theo khối lượng của Mg và Al trong hỗn hợp.
2. Tính nồng độ % của các chất trong dung dịch sau phản ứng.
1. Gọi mol của Mg và Al là x, y mol
=> 24x + 27y = 12,6 (1)
nH2 = 0,6 mol => x + 1,5y = 0,6 (2)
Từ (1) (2) => x = 0,3 ; y = 0,2
=> %Mg = 57,14%
=> %Al = 42,86%
nH2=13,44/22,4=0,6(mol)
Đặt: nMg=a(mol); nAl=b(mol) (a,b>0)
1) PTHH: Mg + H2SO4 -> MgSO4 + H2
a__________a________a_____a(mol)
2Al +3 H2SO4 -> Al2(SO4)3 + 3 H2
b___1,5b______0,5b____1,5b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}24a+27b=12,6\\a+1,5b=0,6\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
=> mMg=0,3.24=7,2(g)
=>%mMg= (7,2/12,6).100=57,143%
=>%mAl=42,857%
2) mMgSO4=120.a=120.0,3=36(g)
mAl2(SO4)3=342.0,5b=342.0,5.0,2= 34,2(g)
mH2SO4= (0,3+0,2.1,5).98=58,8(g)
=>mddH2SO4=58,8: 14,7%=400(g)
=>mddsau= 12,6+400 - 2.0,6= 411,4(g)
=>C%ddAl2(SO4)3= (34,2/411,4).100=8,313%
C%ddMgSO4=(36/411,4).100=8,751%