BT: Cho biết hợp chất nào chứa tỉ lệ phần trăm khối lượng cacbon nhiều hơn trong các hợp chất sau:CO và CO2

Những câu hỏi liên quan
Hóa trị của C trong các hợp chất sau:CO,CH4,CO2 là?
Nguyên tử Y nặng hơn nguyên tử cacbon nhưng nhẹ hơn nguyên tử oxi. Y là?
Cho công thức hóa học X205.Biết phân tử khối 142 đvC.Vậy X là nguyên tố hóa học nào?
Hỗn hợp A chứa 2 ancol no, đơn chức, mạch hở. Để đốt cháy hoàn toàn hỗn hợp A cần dùng vừa hết 3,36 lít
O
2
(đktc). Trong sản phẩm cháy, khối lượng
C
O
2
nhiều hơn khối lượng
H
2
O
là 1,88 g.1. Xác định khối lượng hỗn hợp A.2. Xác định công thức phân tử và phần trăm khối lượng của từng chất trong A nếu biết thêm rằng hai ancol đó khác nhau 2 nguyê...
Đọc tiếp
Hỗn hợp A chứa 2 ancol no, đơn chức, mạch hở. Để đốt cháy hoàn toàn hỗn hợp A cần dùng vừa hết 3,36 lít O 2 (đktc). Trong sản phẩm cháy, khối lượng C O 2 nhiều hơn khối lượng H 2 O là 1,88 g.
1. Xác định khối lượng hỗn hợp A.
2. Xác định công thức phân tử và phần trăm khối lượng của từng chất trong A nếu biết thêm rằng hai ancol đó khác nhau 2 nguyên tử cacbon.
1. Công thức chung của hai ancol là C n H 2 n + 1 O H và tổng số mol của chúng là a. Khối lượng hỗn hợp: (14 n + 18)a.
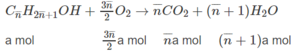
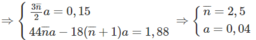
Khối lượng hỗn hợp: (14.2,5 + 18).0,04 = 2,12 (g)
2. n < 2,5 < n + 2 ⇒ 0,5 < n < 2,50
Phần cuối giống như ở cách giải 1.
Đúng 0
Bình luận (0)
Tính thành phần % về khối lượng của nguyên tố oxi có trong hợp các chất: khí cacbon dioxit (CO2) và nhôm oxit (AL2O3). Từ đó hãy xác định trong hợp chất nào có nhiều oxi nhất (chiếm thành phần % theo khối lượng nguyên tố oxi cao nhất.)
Trong $CO_2$ : $\%O = \dfrac{16.2}{44}.100\% = 72,73\%$
Trong $Al_2O_3$ : $\%O = \dfrac{16.3}{102}.100\% = 47,06\%$
Suy ra: $\%O : CO_2 > Al_2O_3$
Đúng 2
Bình luận (0)
nguyên tử x gồm 2 đồng vị tỉ lệ 27:23, đồng vị 1 chứa 35p,44n và đồng vị 2 nhiều hơn 2n, tìm phần trăm khối lượng đồng vị 1 trong hợp chất KX
¯¯¯¯¯¯M=79,92M¯=79,92
Giải thích các bước giải:
X có 35p, đồng vị thứ nhất có 44n ⇒ Số khối của đồng vị thứ nhất: X1=44+35=79X1=44+35=79
Đồng vị thứ 2 nhiều hơn đồng vị thứ nhất 2n ⇒ Số khối của đồng vị thứ 2: X2=81X2=81
⇒ Số khối trung bình
Đúng 2
Bình luận (0)
Cho hợp chất NH 4 OH
a. Tính thành phần phần trăm về khối lượng các nguyên tố trong hợp chất.
b. Tính khối lượng NH 4 OH có chứa 3,2 g oxi.
c. Tính tỉ lệ số phân tử giữa NH 4 OH và khí clo, biết khối lượng NH 4 OH gấp 2 lần khối lượng khí clo.
a) \(M_{NH_4}=14+1.4=18\left(DvC\right)\\ \%N=\dfrac{14}{18}.100\%=78\%\\ \%H=\dfrac{1.4}{18}.100\%=22\%\)
\(M_{OH}=16+1=17\left(DvC\right)\\ \%O=\dfrac{16}{17}.100\%=94\%\\ \%H=100\%-94\%=6\%\)
Đúng 0
Bình luận (0)
Quặng malachite có thành phần chính là hai hợp chất của đồng được ghi bằng công thức chung là 3
C
u
O
H
2
C
O
3
. Khi nung nóng thì hợp chất này bị phân hủy, sản phẩm của phản ứng phân hủy gồm có CuO,
H
2
O
và
C
O
2
. Biết rằng khi nung nóng 4,8...
Đọc tiếp
Quặng malachite có thành phần chính là hai hợp chất của đồng được ghi bằng công thức chung là 3 C u O H 2 C O 3 . Khi nung nóng thì hợp chất này bị phân hủy, sản phẩm của phản ứng phân hủy gồm có CuO, H 2 O và C O 2 . Biết rằng khi nung nóng 4,8kg quặng thì thu được 3,2kg CuO cùng 0,36kg H 2 O và 0,88kg C O 2 . Tính tỉ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng.
Theo định luật bảo toàn khối lượng, khối lượng hai hợp chất của đồng phân hủy bằng:
m C u 2 O H 2 C O 3 = m C u O + m H 2 O + m C O 2 = 3,2 + 0,36 + 0,88 = 4,44(g)
Tỉ lệ phần trăm về khối lượng hai hợp chất của đồng có chứa trong quặng:
mCu2(OH)2CO3 = (4,44 x 100)/ 4,8 = 92,5%
Đúng 0
Bình luận (0)
Canxi cacbonat là thành phần chính của đá vôi. Khi nung đá vôi xảy ra phản ứng hóa học sau: Canxi cacbonat → Canxi oxit + cacbon đioxit. Biết rằng khi nung 280kg đá vôi tạo ra 140kg canxi oxit CaO (vôi sống) và 110kg khí cacbon đioxit CO2. a) Viết công thức về khối lượng của các chất trong phản ứng. b) Tính tỉ lệ phần trăm về khối lượng canxi cacbonat chứa trong đá vôi.
Đọc tiếp
Canxi cacbonat là thành phần chính của đá vôi. Khi nung đá vôi xảy ra phản ứng hóa học sau:
Canxi cacbonat → Canxi oxit + cacbon đioxit.
Biết rằng khi nung 280kg đá vôi tạo ra 140kg canxi oxit CaO (vôi sống) và 110kg khí cacbon đioxit CO2.
a) Viết công thức về khối lượng của các chất trong phản ứng.
b) Tính tỉ lệ phần trăm về khối lượng canxi cacbonat chứa trong đá vôi.
a) mCaCO3 = mCaO + mCO2
b) Khối lượng của CaCO3 đã phản ứng:
140 + 110 = 250 kg
Tỉ lệ phần trăm khối lượng CaCO3 chứa trong đá vôi:
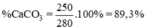
Đúng 3
Bình luận (1)
Hỗn hợp M chứa ancol no A và axit cacboxylic đơn chức B, cả hai đều mạch hở. Tổng số mol 2 chất trong hỗn hợp M là 0,5 mol. Để đốt cháy hoàn toàn hỗn hợp M cần dùng vừa hết 30,24 lít
O
2
. Sản phẩm cháy gồm có 23,4 g H2O và 26,88 lít
C
O
2
. Các thể tích đo ở đktc.Hãy xác định công thức phân tử, công thức cấu tạo, tên gọi và phần trăm khối lượng từng chất trong hỗn hợp M, biết rằng chất B hơn chất A m...
Đọc tiếp
Hỗn hợp M chứa ancol no A và axit cacboxylic đơn chức B, cả hai đều mạch hở. Tổng số mol 2 chất trong hỗn hợp M là 0,5 mol. Để đốt cháy hoàn toàn hỗn hợp M cần dùng vừa hết 30,24 lít O 2 . Sản phẩm cháy gồm có 23,4 g H2O và 26,88 lít C O 2 . Các thể tích đo ở đktc.
Hãy xác định công thức phân tử, công thức cấu tạo, tên gọi và phần trăm khối lượng từng chất trong hỗn hợp M, biết rằng chất B hơn chất A một nguyên tử cacbon.
Khi đốt 0,5 mol hỗn hơp M, số mol C O 2 thu đươc là :
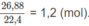
Nếu đốt 1 mol hỗn hợp M, số mol C O 2 thu được sẽ là 2,4 (mol).
Như vậy chất A và chất B có chứa trung bình 2,40 nguyên tử cacbon , chất A lại kém chất B 1 nguyên tử cacbon. Vậy, A có 2 và B có 3 nguyên tử cacbon.
A là ancol no có 2 cacbon: C 2 H 6 - x ( O H ) x hay C 2 H 6 O x
B là axit đơn chức có 3 cacbon: C 3 H y O 2 .
Đặt số mol A là a, số mol B là b :
a + b = 0,5 (1)
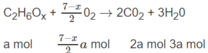
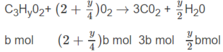
Số mol O 2 là: (3,5 - 0,5x)a + (2 + 0,25y)b = 1,35 (mol) (2)
Số mol C O 2 là: 2a + 3b = 1,2 (mol) (3)
Số mol C O 2 là:
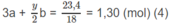
Giải hệ phương trình đại số tìm được: a = 0,3; b = 0,2; x = 2; y = 4.
Chất A:
C
2
H
6
O
2
hay 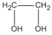 etanđiol (hay etylenglicol)
etanđiol (hay etylenglicol)
Chiếm  khối lượng M.
khối lượng M.
Chất B: C 3 H 4 O 2 hay C H 2 = C H - C O O H , axit propenoic chiếm 43,64% khối lượng M.
Đúng 0
Bình luận (0)
Tìm CTHH của hợp chất tạo bởi cacbon và oxi, biết tỉ lệ khối lượng giữa Cacbon và Oxi trong hợp chất này là 3:8
Gọi CTHH là CxOy
Ta có: \(\dfrac{m_C}{m_O}=\dfrac{3}{8}\Rightarrow\dfrac{xM_c}{yM_O}=\dfrac{12x}{16y}=\dfrac{3}{8}\Leftrightarrow\dfrac{x}{y}=\dfrac{1}{2}\)
Vậy CTHH: CO2
Đúng 1
Bình luận (1)















