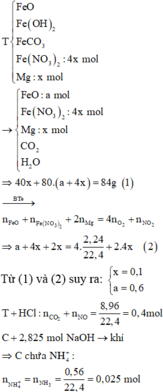để 14,8g hổn hợp gồm Fe và Cu trong khí O2 ,sau một thời gian thu được 19,2g hổn hợp X gồm CuO , Fe2O3 ,FeO ,Fe3O4 .Hổn hợp X tác dụng vừa đủ với m gam axit HCl . a, viết PTHH. b, tính thể tích khí O2 ( đktc) đã phản ứng. c, tính m

Những câu hỏi liên quan
Để 14.8g hỗn hợp gồm Fe và Cu trong khí Oxi sau 1 thời gian thu được19.2g hỗn hợp X gồm CuO ,Fe2O3,FeO,Fe3O4 hỗn hợp X tác dụng vừa đủ với m g HCl a) Viết PTHH b) Tính V O2(ĐKTC) đã phản ứng c) Tính m
\(a) 4Fe + 3O_2 \xrightarrow{t^o} 2Fe_2O_3\\ 2Fe + O_2 \xrightarrow{t^o}2FeO\\ 3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\)
b)
Bảo toàn khối lượng :
\(m_{kim\ loại} + m_{O_2} = m_{oxit}\\ \Rightarrow n_{O_2} = \dfrac{19,2-14,8}{32} = 0,1375(mol)\\ V_{O_2} = 0,1375.22,4 =3,08(lít)\)
c)
\(n_{O(oxit)} = 2n_{O_2} = 0,1375.2 = 0,275(mol)\\ 2H^+ + O^{2-} \to H_2O\\ n_{HCl} = n_{H^+} = 2n_O = 0,275.2 = 0,55(mol)\\ m = 0,55.36,5 = 20,075(gam)\)
Đúng 1
Bình luận (0)
Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 3 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là A. 46,4 gam B. 23,2 gam C. 11,6 gam D. 34,8 gam
Đọc tiếp
Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 3 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là
A. 46,4 gam
B. 23,2 gam
C. 11,6 gam
D. 34,8 gam
Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 3 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là: A. 46,4 gam B. 23,2 gam C. 11,6 gam D. 34,8 gam
Đọc tiếp
Khử m gam Fe3O4 bằng khí H2 thu được hổn hợp X gồm Fe và FeO, hỗn hợp X tác dụng vừa hết với 3 lít dung dịch H2SO4 0,2M (loãng). Giá trị của m là:
A. 46,4 gam
B. 23,2 gam
C. 11,6 gam
D. 34,8 gam
Đáp án A
Fe3O4 → FeO , Fe → FeSO4
Nhận thấy sau phản ứng chỉ thu được FeSO4 → nFeSO4 = nSO4 2- = 0,6 mol
Bảo toàn nguyên tố Fe → nFe3O4 = 0,6: 3= 0,2 mol
→ m= 46,4 gam.
Đúng 0
Bình luận (0)
Cho 18,8g gram một hỗn hợp gồm Al và MgO tác dụng với dung dịch HCl 1,6 M vừa đủ thì thoát ra 6,72 lít khí Hidro ( thu được ở đktc ) a) Tính % theo khối lượng của Nhôm và Magie oxit trong hổn hợp ban đầu. b) Tính thể tích axit HCl đã dùng. c) Dùng toàn bộ lượng khí Hidro thu được đem thử hoàn toàn 1 lượng sắt oxit vừa đủ là 17,4 gram. Xác định công thức hóa học của oxit sắt. Help me
a)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$MgO + 2HCl \to MgCl_2 + H_2O$
Theo PTHH : $n_{Al} = \dfrac{2}{3}n_{H_2} = 0,2(mol)$
$\%m_{Al} = \dfrac{0,2.27}{18,8}.100\% = 28,7\%$
$\%m_{MgO} = 100\% - 28,7\% =71,3\%$
b) $n_{MgO} = 0,335(mol)$
Theo PTHH : $n_{HCl} = 2n_{H_2} + 2n_{MgO} =1,27(mol)$
$V_{dd\ HCl} = \dfrac{1,27}{1,6} = 0,79375(lít)$
c)
$H_2 + O_{oxit} \to H_2O$
$\Rightarrow n_{O(oxit)} = n_{H_2} = 0,3(mol)$
$\Rightarrow n_{Fe} = \dfrac{17,4 - 0,3.16}{56} = 0,225(mol)$
Ta có :
$n_{Fe} : n_O = 0,225 : 0,3 = 3 : 4$
Vậy oxit là $Fe_3O_4$
Đúng 1
Bình luận (0)
Hỗn hợp X gồm MgO , FeO , CuO , Fe2O3 và Fe3O4 Để hòa hoàn toàn m gam X thì cần dùng vừa đủ 100 ml dung dịch gồm HCl 2M và H2SO4 1M . Mặt khác , cho khí CO qua m gam X nung nóng , sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào bình đựng 60 ml dung dịch Ca(OH)2 1M. đến khi phản ứng hoàn toàn thu được kết tủa và dung dịch T. Cho tiếp dung dịch Ba(OH)2 dư vào dung dịch T thấy kết tủa lại xuất hiện . Khi phản ứng kết thúc , tổng khối lượng hai lần kết tủa thu được là 12...
Đọc tiếp
Hỗn hợp X gồm MgO , FeO , CuO , Fe2O3 và Fe3O4 Để hòa hoàn toàn m gam X thì cần dùng vừa đủ 100 ml dung dịch gồm HCl 2M và H2SO4 1M . Mặt khác , cho khí CO qua m gam X nung nóng , sau một thời gian thu được hỗn hợp rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào bình đựng 60 ml dung dịch Ca(OH)2 1M. đến khi phản ứng hoàn toàn thu được kết tủa và dung dịch T. Cho tiếp dung dịch Ba(OH)2 dư vào dung dịch T thấy kết tủa lại xuất hiện . Khi phản ứng kết thúc , tổng khối lượng hai lần kết tủa thu được là 12,895 gam . Cho toàn bộ chất rắn Y vào dung dịch H2SO4 đặc , nóng (dư ), kết thúc phản ứng thu được 2,688 lít khi SO2 (đkc sản phẩm khử duy nhất ) và dung dịch chứa 30,4 gam muối , tính m.
Hổn hợp X gồm propan, etilen, propin. Dẫn 2,24 lít hổn hợp X qua dd brom dư thấy có 20,8g brom phản ứng . Đốt cháy hoàn toàn khí thoát ra thu được 1,44 gam H2O. a. Viết các pthh xảy ra và tính phần trăm thể tích mỗi khí có trong hh X B. Dẫn 9,3 gam hh X qua dd AgNO3/ NH3 dư thu được bao nhiêu gam kết tủa
Nung m gam hỗn hợp T gồm FeO, Fe(OH)2, FeCO3, Fe(NO3)2 (4x mol) và Mg (x mol) trong bình kín có chứa 2,24 lít khí O2. Sau khi phản ứng xảy ra hoàn toàn, thu được 84 gam hỗn hợp rắn X gồm MgO, Fe2O3 và hỗn hợp Y gồm 3 khí và hơi. Cho m gam T tác dụng với dung dịch HCl vừa đủ, thu được dung dịch C và 8,96 lít hỗn hợp khí gồm NO và CO2. Cho C tác dụng vừa đủ với dung dịch chứa 2,825 mol NaOH, thu được 0,56 lít khí duy nhất. Phần trăm số mol của FeCO3 trong T là A. 17,17%. B. 18,18%. C. 19,19%. D...
Đọc tiếp
Nung m gam hỗn hợp T gồm FeO, Fe(OH)2, FeCO3, Fe(NO3)2 (4x mol) và Mg (x mol) trong bình kín có chứa 2,24 lít khí O2. Sau khi phản ứng xảy ra hoàn toàn, thu được 84 gam hỗn hợp rắn X gồm MgO, Fe2O3 và hỗn hợp Y gồm 3 khí và hơi. Cho m gam T tác dụng với dung dịch HCl vừa đủ, thu được dung dịch C và 8,96 lít hỗn hợp khí gồm NO và CO2. Cho C tác dụng vừa đủ với dung dịch chứa 2,825 mol NaOH, thu được 0,56 lít khí duy nhất. Phần trăm số mol của FeCO3 trong T là
A. 17,17%.
B. 18,18%.
C. 19,19%.
D. 20,20%.
Hoà tan hoàn toàn 57,6 gam hỗn hợp X gồm Fe3O4, Fe2O3, FeO và Fe trong dung dịch HCl thì cần dùng 360 gam dung dịch HCl 18,25% để tác dụng vừa đủ. Sau phản ứng thu được V lít khí H2 và dung dịch Y. Cho toàn bộ H2 sinh ra tác dụng hết với 43,2g CuO ở nhiệt độ cao, sau phản ứng thu được 40g rắn. a) cô cạn dung dịch Y thì thu được bao nhiêu gam muối khan ? b) Nếu trong X, nFe2O3=nFeO. tính C% các chất trong Y
Xem chi tiết
a) \(n_{HCl}=\dfrac{360.18,25\%}{36,5}=1,8\left(mol\right)\)
H2 + CuO ------t°----->Cu + H2O
\(n_{CuO}=\dfrac{43,2}{80}=0,54\left(mol\right)\)
Gọi nCuO phản ứng = x (mol)
Theo đề bài
m chất rắn = \(m_{CuO\left(dư\right)}+m_{Cu}=\left(0,54-x\right).80+x.64=40\)
=> x = 0,2 mol
=> n H2 = 0,2 (mol)
=> m H2 = 0,2 . 2 =0,4 (g)
Fe + 2HCl → FeCl2 + H2 (*)
Theo PT : \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
=> Số mol HCl tác dụng với Fe3O4, Fe2O3, FeO là 1,8 - 0,4 = 1,4 mol
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O (1)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O (2)
FeO + 2HCl → FeCl2 + H2O (3)
Bảo toàn nguyên tố H : \(n_{H_2O}.2=n_{HCl}.1\)
\(\Rightarrow n_{H_2O}=\dfrac{1,4}{2}=0,7\left(mol\right)\)
Áp dụng định luật bảo toàn khối lượng, ta có:
mhỗn hợp + mHCl = mmuối + mH2O + mH2
57,6 + 1,8.36,5 = mmuối + 0,7.18 + 0,4
mmuối= a = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)
Đúng 1
Bình luận (0)
b) Từ PT (*) => \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
Nếu trong X, nFe2O3=nFeO
=> Gộp 2 oxit trên thành Fe3O4
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
\(n_{Fe_3O_4}=\dfrac{57,6-0,2.56}{232}=0,2\left(mol\right)\)
\(n_{FeCl_3}=2n_{Fe_3O_4}=0,4\left(mol\right)\)
\(n_{FeCl_2}=n_{Fe_3O_4}=0,2\left(mol\right)\)
\(m_{ddsaupu}=57,6+360-0,4=417,2\left(g\right)\)
=> \(C\%_{FeCl_3}=\dfrac{0,4.162,5}{417,2}.100=15,58\%\)
\(C\%_{FeCl_2}=\dfrac{0,2.127}{417,2}.100=6,09\%\)
Đúng 0
Bình luận (0)
Một hổn hợp khí gồm có : 4,8(g) O2 và 3(g) H2 tính
A )Thể tích của hỗn hợp khí trên ở đktc ?
B) đốt hỗn hợp khí trên bằng tia lửa điện . Hãy viết PTHH và tính khối lượng nước thu được sau khi phản ứng
C) hòa tan 9,2g kim loại M(I) vào lượng nước trên thì sau phản ứng thu được vừa đủ 4,48 lit khí video (đktc) . Hãy tìm tên kim loại và tính nồng độ phần trăm của dung dịch sau phản ứng ? ( mn giải giúp e vs , e đag cần gấp ạ , em cảm ơn )
Đọc tiếp
Một hổn hợp khí gồm có : 4,8(g) O2 và 3(g) H2 tính A )Thể tích của hỗn hợp khí trên ở đktc ? B) đốt hỗn hợp khí trên bằng tia lửa điện . Hãy viết PTHH và tính khối lượng nước thu được sau khi phản ứng C) hòa tan 9,2g kim loại M(I) vào lượng nước trên thì sau phản ứng thu được vừa đủ 4,48 lit khí video (đktc) . Hãy tìm tên kim loại và tính nồng độ phần trăm của dung dịch sau phản ứng ? ( mn giải giúp e vs , e đag cần gấp ạ , em cảm ơn )
a, \(n_{O_2}=\dfrac{4,8}{32}=0,15\left(mol\right)\)
\(n_{H_2}=\dfrac{3}{2}=1,5\left(mol\right)\)
\(\Rightarrow V_{hh}=V_{O_2}+V_{H_2}=0,15.22,4+1,5.22,4=36,96\left(l\right)\)
b, PT: \(O_2+2H_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,15}{1}< \dfrac{1,5}{2}\), ta được H2 dư.
Theo PT: \(n_{H_2O}=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{H_2O}=0,3.18=5,4\left(g\right)\)
c, Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2M+2H_2O\rightarrow2MOH+H_2\)
Theo PT: \(n_M=2n_{H_2}=0,4\left(mol\right)\Rightarrow M_M=\dfrac{9,2}{0,4}=23\left(g/mol\right)\)
Vậy: M là Natri (Na).
Ta có: m dd sau pư = 9,2 + 5,4 - 0,2.2 = 14,2 (g)
Theo PT: \(n_{NaOH}=2n_{H_2}=0,4\left(mol\right)\Rightarrow m_{NaOH}=0,4.40=16\left(g\right)\)
Đến đây thì m chất tan lại lớn hơn cả m dd sau pư. Không biết đề có nhầm lẫn gì không bạn nhỉ?
Đúng 1
Bình luận (0)