1. Một hỗn hợp X gồm Al và Al2o3 có %o là 30,77%.
Tính thành phần % theo số mol của X
Một hỗn hợp gồm Al, Al2O3 có thành phần % Oxi là 30,77%.
a, Tính phần trăm theo số mol của hỗn hợp X
b, Hòa tan 156g X trong 5l dung dịch Y chứa NaOH 0,6M, chứa KOH 0,4M. X tan hết hay không ?
c, Tình V H2 (ĐKTC) Dung dịch sau p/u gọi là dd Z. Phải thêm vào dd Z bao nhiêu l dd R chứa HCl 1,2M và H2SO4 0,4M để:
+ dd bắt đầu có kết tủa, kết tủa cực đại, kết tủa tan hết.
Hỗn hợp X gồm Mg và Al được chia làm hai phần bằng nhau.
Phần 1: tan hết trong dung dịch HCl, thấy thoát ra 5,376 lít khí (đktc).
Phần 2: tác dụng với dung dịch NaOH 1M thấy có 80 ml dung dịch đã phản ứng.
Thành phần % theo số mol của Al trong hỗn hợp là
A. 40,00%
B. 68,32%
C. 57,14%
D. 42,86%
Cho 5,04 lít hỗn hợp khí X (đtc) gồm Cl2 và O2 tác dụng vừa đủ với 7,8 gam hỗn hợp Y gồm Mg và Al thu được 16,95gam hỗn hợp Z gồm MgCl2; MgO; AlCl3 và Al2O3. Phần trăm khối lương của Al trong Y là A. 30,77. B. 22,26. C. 19,79. D. 69,23.
\(m_{hh.X}=16,95-7,8=9,15\left(g\right)\)
\(n_{hh.X}=\frac{5,04}{22,4}=0,225\left(mol\right)\)
Gọi số mol của Cl2 là a , số mol của O2 là b
Giải hệ PT:
\(\left\{{}\begin{matrix}71a+32b=9,16\\a+b=0,225\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}a=0,05\\b=0,175\end{matrix}\right.\)
Gọi số mol của Al là x , số mol của Mg là y
Giải hệ PT:
\(\left\{{}\begin{matrix}27x+24y=7,8\\3x+2y=4.0,175+0,05.2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(\Rightarrow\%m_{Al}=\frac{0,2.27}{7,8}.100\%=69,23\%\)
Khi cho 56,6 gam hỗn hợp X gồm Fe 2 O 3 , Cr 2 O 3 và Al 2 O 3 tác dụng với dung dịch NaOH đặc dư, sau phản ứng thu được chất rắn có khối lượng 16 gam. Để khử hoàn toàn 28,3 gam X bằng phản ứng nhiệt nhôm phải dùng 8,1 gam Al. Thành phần phần trăm theo khối lượng của Al 2 O 3 trong hỗn hợp X là
A. 24,64%
B. 18,02%
C. 17,31%
D. 36,71%
Khi cho 20,7 gam hỗn hợp X gồm Fe 2 O 3 , Cr 2 O 3 và Al 2 O 3 tác dụng với dung dịch NaOH đặc dư, sau phản ứng thu được chất rắn có khối lượng 8 gam. Để khử hoàn toàn 41,4 gam X bằng phản ứng nhiệt nhôm phải dùng 10,8 gam Al. Thành phần phần trăm theo khối lượng của Al 2 O 3 trong hỗn hợp X là
A. 24,64%
B. 66,67%
C. 50,67%
D. 36,71%
Một hỗn hợp X gồm H2 và O2 (ko cs phản ứng xảy ra) có tỉ khối so vs ko khí là 0,3276
a) Tính khối lượng mol trung bình của hỗn hợp
b) Tính thành phần phần trăm theo số mol của mỗi khí trong hỗn hợp (= 2 cách khác nhau)
theo đề ra ta có
dx/kok = \(\dfrac{M_X}{29}\) = 0,3276 => Mx =9,5
gọi x và y lần lượt là số mol của H2 và O2
nx = x + y
mx = 2x + 32y
\(\overline{M}\) = \(\dfrac{2x+32y}{x+y}=9,2\)
x = 22,5 y =77,5
Nung hỗn hợp gồm 0,12 mol Al và 0,04 mol Fe3O4 một thời gian, thu được hỗn hợp rắn X gồm Al , Fe , FeO , Fe3O4 , Al2O3 . Hòa tan hoàn toàn X trong dung dịch HCl dư thu được 0,15 mol khí H2 và m gam muối. Giá trị của m là
A. 41,97
B. 32,46
C. 32,79
D. 31,97
Chọn đáp án D
Một câu hỏi được đặt ra ngay là .H trong HCl đi đâu ?
Hỏi vớ vẩn ...biến thành nước và H2 ...Đừng hỏi O ở đâu kết hợp với H trong HCl thành nước nhé
Rồi ok
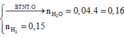
![]()
![]()
=32,97(g)
Hòa tan hoàn toàn 7,8 gam hỗn hợp X gồm Al và Al 2 O 3 trong lượng dư dung dịch NaOH, thu được 3,36 lít H 2 . Số mol của Al 2 O 3 có trong 15,6 gam X trên là
A. 0,15
B. 0,05
C. 0,10
D. 0,20
Hoà tan hết hỗn hợp X gồm Mg, Al, Al2O3 tác dụng với dd NaOH dư thu được 0.15 mol H2. Nếu cũng cho hỗn hợp X trên tác dụng hết với HCl thì thu được 0,35 mol H2. Sô mol Mg và Al trong hỗn hợp X theo thứ tự là bao nhiêu ?
$2Al + 2NaOH + 2H_2O \to 2NaAlO_2 + 3H_2$
$n_{Al} = \dfrac{2}{3}n_{H_2} = \dfrac{2}{3}.0,15 = 0,1(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Mg + 2HCl \to MgCl_2 + H_2$
$n_{H_2} = \dfrac{3}{2}n_{Al} + n_{Mg} = 0,35(mol)$
$\Rightarrow n_{Mg} = 0,35 - 0,15 = 0,2(mol)$
Vậy số mol Mg và Al là 0,2 và 0,1