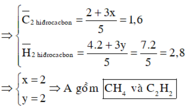Đốt cháy 1 hợp chất hữu cơ A thu đc CO2 và hơi nước theo tỉ lệ là 3/2 và tỉ khối A/H2=36. Biết V các khí đo ở cùng điều kiện nhiệt độ và áp suất. Xác định công thức cấu tạo phân tử A

Những câu hỏi liên quan
Khi đốt cháy 1 lít hợp chất hữu cơ a cần 5 lít khi oxi. sau phản ứng thu được 3 lít khí co2 và 4 lít hơi nước. xác định công thức phân tử của a, biết thế tích các khí đo ở cùng điều kiện nhiệt độ và áp suất.
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
BTNT O, có: \(V_{O\left(trongA\right)}+2V_{O_2}=2V_{CO_2}+V_{H_2O}\Rightarrow V_{O\left(trongA\right)}=0\)
Vậy: A chỉ gồm C và H.
Gọi CTPT của A là CxHy.
\(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{n_{CO_2}}{n_A}=3\\y=\dfrac{2n_{H_2O}}{n_A}=8\end{matrix}\right.\)
Vậy: CTPT cần tìm là C3H8
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn chất hữu cơ A có tỉ lệ khối lượng mC : mO = 3 : 2, thu được khí CO2 và hơi nước theo tỉ lệ thể tích CO2 : H2O = 4 : 3 ở cùng nhiệt độ và áp suất. Xác định CTPT của A
Tỉ lệ về thể tích bằng tỉ lệ về số mol
Coi $n_{CO_2} = 4(mol) \Rightarrow n_{H_2O} = 3(mol)$
Bảo toàn nguyên tố C, H :
$n_C = n_{CO_2} = 4(mol) ; n_H = 2n_{H_2O} = 6(mol)$
$m_C = 4.12 = 48(gam)$
$\Rightarrow m_O = 48.\dfrac{2}{3} = 32(gam)$
$\Rightarrow n_O = \dfrac{32}{16} = 2(mol)$
Ta có :
$n_C : n_H : n_O = 4 : 6 : 2 = 2 : 3 : 1$
Vậy CTPT của A là $(C_2H_3O)_n$
Với n = 2 thì tồn tại CTCT : $OH-CH_2-C \equiv C-CH_2-OH$
Vậy CTPT là $C_2H_6O_2$
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 2,82 gam chất hữu cơ A cần 2,856 lít khs O2 thu được khí CO2 và hơi nước theo tỉ lệ thể tích Vco2/Vh2o = 4/3 ( các khi đo ở điều kiện tiêu chuẩn ) . Hãy xác định công thức phân tử của A . Biết tỉ khối của A với không khí nhỏ hơn 7
Ta có: \(n_{O_2}=\dfrac{2,856}{22,4}=0,1275\left(mol\right)\)
\(\dfrac{V_{CO_2}}{V_{H_2O}}=\dfrac{4}{3}\Rightarrow\dfrac{n_{CO_2}}{n_{H_2O}}=\dfrac{4}{3}\)
Gọi: nCO2 = 4x (mol) ⇒ nH2O = 3x (mol)
Theo ĐLBT KL, có: mA + mO2 = mCO2 + mH2O
⇒ 2,82 + 0,1275.32 = 4x.44 + 3x.18
⇒ x = 0,03
⇒ nCO2 = 0,03.4 = 0,12 (mol) = nC
nH2O = 0,03.3 = 0,09 (mol) ⇒ nH = 0,09.2 = 0,18 (mol)
Ta có: mC + mH = 0,12.12 + 0,18.1 = 1,62 (g) < 2,82 (g)
→ A chứa C, H và O.
⇒ mO = 2,82 - 1,62 = 1,2 (g) \(\Rightarrow n_O=\dfrac{1,2}{16}=0,075\left(mol\right)\)
Gọi CTPT của A là CxHyOz
⇒ x:y:z = 0,12:0,18:0,075 = 8:12:5
→ CTPT của A có dạng là (C8H12O5)n (n nguyên dương)
Mà: \(M_A< 29.7=203\left(g/mol\right)\)
\(\Rightarrow\left(12.8+12.1+16.5\right)n< 203\)
⇒ n < 1,08 ⇒ n = 1
Vậy: CTPT của A là C8H12O5.
Đúng 1
Bình luận (2)
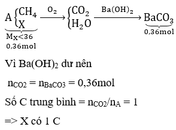
Hỗn hợp A gồm metan và một hợp chất hữu cơ X. Tỉ khối hơi của X so với hiđro nhỏ hơn 18. Đốt cháy hoàn toàn V lít A thu được sản phẩm chỉ gồm CO2 và H2O. Cho sản phẩm cháy hấp thụ hết vào dung dịch Ba(OH)2 lấy dư thấy tạo thành 70,92 gam kết tủa. Xác định các công thức phân tử có thể có của X. Biết rằng: V lít A đúng bằng thể tích của 11,52 gam khí O2 được đo trong cùng điều kiện nhiệt độ và áp suất.
Đọc tiếp
Hỗn hợp A gồm metan và một hợp chất hữu cơ X. Tỉ khối hơi của X so với hiđro nhỏ hơn 18. Đốt cháy hoàn toàn V lít A thu được sản phẩm chỉ gồm CO2 và H2O. Cho sản phẩm cháy hấp thụ hết vào dung dịch Ba(OH)2 lấy dư thấy tạo thành 70,92 gam kết tủa. Xác định các công thức phân tử có thể có của X. Biết rằng: V lít A đúng bằng thể tích của 11,52 gam khí O2 được đo trong cùng điều kiện nhiệt độ và áp suất.
Đốt cháy hoàn toàn hợp chất hữu cơ X (chứa các nguyên tố C, H, O) thu được khí CO2 và hơi H2Otheo tỉ lệ thể tích 6 : 5 (đo ở cùng điều kiện nhiệt độ, áp suất). a) Tìm công thức phân tử của X, biết tỉ khối hơi của X so với He bằng 36,5. b) Để đốt cháy hoàn toàn p gam X cần 7,28 lít O2 (đktc). Tính p c) Cho 14,6 gam X phản ứng hoàn toàn với dung dịch KOH thì thu được muối của một axit cacboxylic và 9,2 gam ancol. + Xác định công thức cấu tạo có thể có của X + Trong số các công thức cấu tạo của X ở...
Đọc tiếp
Đốt cháy hoàn toàn hợp chất hữu cơ X (chứa các nguyên tố C, H, O) thu được khí CO2 và hơi H2Otheo tỉ lệ thể tích 6 : 5 (đo ở cùng điều kiện nhiệt độ, áp suất).
a) Tìm công thức phân tử của X, biết tỉ khối hơi của X so với He bằng 36,5.
b) Để đốt cháy hoàn toàn p gam X cần 7,28 lít O2 (đktc). Tính p
c) Cho 14,6 gam X phản ứng hoàn toàn với dung dịch KOH thì thu được muối của một axit cacboxylic và 9,2 gam ancol.
+ Xác định công thức cấu tạo có thể có của X
+ Trong số các công thức cấu tạo của X ở trên, công thức nào phù hợp với điều kiện sau: lấy 9,2 gam ancol ở trên cho tác dụng với Na dư sau phản ứng khí thoát ra vượt quá 3,0 lít (đktc).
a) MX = 146g/mol
VCO2 : VH2O = 6 : 5
=> nC : nH = 3 : 5
=> CTĐGN: (C3H5Oa)n
→ (41 + 16a).n = 146 → (a; n) = (4; 2) → X: C6H10O4
b) C6H10O4 + 6,5O2 → 6CO2 + 5H2O
0,05 0,325
=> p = 7,3g
c)
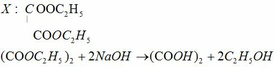
Đúng 0
Bình luận (0)
Hỗn hợp khí A chứa hai hiđrocacbon, hỗn hợp khí B chứa O2 và O3 (tỉ khối của B so với H2 là 18,4). Trộn A và B theo tỉ lệ 1 : 2 về thể tích rồi đốt cháy thì chỉ còn CO2 và hơi H2O theo tỉ lệ 8 : 7 về thể tích. Nếu dẫn 5 lít A qua nước brom dư thì thể tích khí còn lại 2 lít. Công thức phân tử của hai hiđrocacbon là (các thể tích khí đo cùng điều kiện nhiệt độ, áp suất) A. CH4 và C3H6. B. CH4 và C4H2. C. CH4 và C2H2. D. CH4 và C3H4.
Đọc tiếp
Hỗn hợp khí A chứa hai hiđrocacbon, hỗn hợp khí B chứa O2 và O3 (tỉ khối của B so với H2 là 18,4). Trộn A và B theo tỉ lệ 1 : 2 về thể tích rồi đốt cháy thì chỉ còn CO2 và hơi H2O theo tỉ lệ 8 : 7 về thể tích. Nếu dẫn 5 lít A qua nước brom dư thì thể tích khí còn lại 2 lít. Công thức phân tử của hai hiđrocacbon là (các thể tích khí đo cùng điều kiện nhiệt độ, áp suất)
A. CH4 và C3H6.
B. CH4 và C4H2.
C. CH4 và C2H2.
D. CH4 và C3H4.
Hợp chất hữu cơ T mạch hở, được tạo thành từ hai ancol (có cùng số nguyên tử cacbon) và một axit cacboxylic hai chức. Đốt cháy hoàn toàn 1,76 gam T cần 1,68 lít khí O2 (đktc), thu được CO2 và hơi H2O với tỉ lệ thể tích VCO2 : VH2O 7 : 6. Biết các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất; công thức phân tử của T trùng với công thức đơn giản nhất. Tên gọi hai ancol tạo thành T là A. ancol propylic và ancol isopropylic B. ancol propylic và propan-1,2-điol C. ancol etylic và ety...
Đọc tiếp
Hợp chất hữu cơ T mạch hở, được tạo thành từ hai ancol (có cùng số nguyên tử cacbon) và một axit cacboxylic hai chức. Đốt cháy hoàn toàn 1,76 gam T cần 1,68 lít khí O2 (đktc), thu được CO2 và hơi H2O với tỉ lệ thể tích VCO2 : VH2O = 7 : 6. Biết các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất; công thức phân tử của T trùng với công thức đơn giản nhất. Tên gọi hai ancol tạo thành T là
A. ancol propylic và ancol isopropylic
B. ancol propylic và propan-1,2-điol
C. ancol etylic và etylen glicol
D. propan-1,2-điol và glixerol
Chọn đáp án C
♦ giải đốt 1 , 76 g a m T + 0 , 075 m o l O 2 → t 0 7 C O 2 + 6 H 2 O
BTKL có m C O 2 + m H 2 O = 1 , 76 + 0 , 075 × 32 = 4 , 16 g a m
Giả thiết n C O 2 : n H 2 O = 7 : 6 → n C O 2 = 0 , 07 m o l ; n H 2 O = 0 , 06 m o l
bảo toàn có n O trong T = 0,05 mol
→ tỉ lệ n C : n H : n O = 7 : 12 : 5
→ CTPT của T là C 7 H 12 O 5 . Số O = 5; axit 2 chức có 4O
→ còn 1O của nhóm -OH ancol chưa phản ứng nữa mới đủ.
→ 2 ancol có cùng số C và 1 ancol đơn chức; 1 ancol còn lại hai chức.
ancol 2 chức, axit 2 chức thì phải từ C2 trở đi
→ 7 = 2 × 2 + 3
→ CTCT của T là C 2 H 5 O O C - C H 2 - C O O C H 2 C H 2 O H
→ 2 ancol là ancol etylic ( C 2 H 5 O H ) và etylen glicol ( C 2 H 4 ( O H ) 2 )
Đúng 0
Bình luận (0)
Khi đốt cháy hoàn toàn hiđrocacbon A, thu được khí
C
O
2
và hơi nước theo tỉ lệ 77 : 18 về khối lượng. Nếu làm bay hơi hết 5,06 gam A thì thể tích hơi thu được đúng bằng thể tích của 1,76 g
O
2
ở cùng nhiệt độ và áp suất.1. Xác định công thức phân tử của chất A.2. Chất A không tác dụng với nước brom nhưng tác dụng được với dung dịch
K
M
n
O
4...
Đọc tiếp
Khi đốt cháy hoàn toàn hiđrocacbon A, thu được khí C O 2 và hơi nước theo tỉ lệ 77 : 18 về khối lượng. Nếu làm bay hơi hết 5,06 gam A thì thể tích hơi thu được đúng bằng thể tích của 1,76 g O 2 ở cùng nhiệt độ và áp suất.
1. Xác định công thức phân tử của chất A.
2. Chất A không tác dụng với nước brom nhưng tác dụng được với dung dịch K M n O 4 khi đun nóng. Viết công thức cấu tạo và tên chất A.
1. 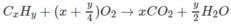
Theo đầu bài ta có: 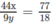
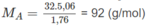
Tức là 12x + y = 92,0 ⇒ x = 7 ; y = 8
Công thức phân tử chất A là C 7 H 8 .
2. Công thức cấu tạo
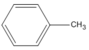 (metylbenzen (toluen))
(metylbenzen (toluen))
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn hỗn hợp 2 amin no đơn chức, mạch hở thu được CO2 và hơi nước theo tỉ lệ VCO2 : VH2O 1:2 (các thể tích đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của 2 amin đó là A. CH3NH2 và C2H5NH2 B. C2H5NH2 và C3H7NH2 C. C3H7NH2 và C4H9NH2 D. C2H5NH2 và C4H9NH2
Đọc tiếp
Đốt cháy hoàn toàn hỗn hợp 2 amin no đơn chức, mạch hở thu được CO2 và hơi nước theo tỉ lệ VCO2 : VH2O = 1:2 (các thể tích đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của 2 amin đó là
A. CH3NH2 và C2H5NH2
B. C2H5NH2 và C3H7NH2
C. C3H7NH2 và C4H9NH2
D. C2H5NH2 và C4H9NH2