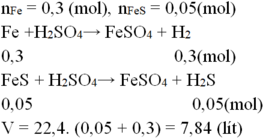Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu trong dung dịch H2SO4 loãng, phản ứng xong thu được 6,4 gam rắn không tan. Tính thể tích khí thoát ra ở đktc

Những câu hỏi liên quan
Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu trong dung dịch HCl, phản ứng xong thu được 6,4 gam rắn không tan. Tính thể tích khí thoát ra ở đktc.
Theo bài ra, ta có: \(m_{Cu}=6,4\left(g\right)\)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(n_{Fe}=\dfrac{12-6,4}{56}=0,1\left(mol\right)=n_{H_2}\)
\(\Rightarrow V_{H_2}=0,1\cdot22,4=2,24\left(l\right)\)
Đúng 3
Bình luận (0)
m Fe=12-6,4= 5,6g
Fe+2HCl>FeCl2+H2
0,1------------------0,1
n Fe=0,1 mol
=>VH2=0,1.22,4=2,24l
Đúng 1
Bình luận (0)
Gọi nfe=x (mol) ncu=y (mol)
=>56x+64y=12 (1)
Fe+2HCl---->FeCl2+H2
x-------------------------->x (mol)
ncu=\(\dfrac{6,4}{64}=y=0,1\) (mol)
Thay y=0,1 vào (1) ta được:
56x+64.0,1=12
<=>56x+6,4=12
<=>56x=5,6
<=>x=0,1
=>nH2=x=0,1 (mol)
VH2=0,1.22,4=2,24(l)
Đúng 0
Bình luận (0)
Hòa tan 6 gam hỗn hợp A gồm Fe và Cu trong dung dịch H2SO4 loãng dư, sau khi phản ứng xảy ra hoàn toàn thu được 1,12 lít khí H2 (đktc) và còn lại m gam chất rắn không tan. Giá trị của m là
A. 1,6
B. 2,8
D. 4,8
D. 3,2
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
____0,05<------------------------0,05
=> mFe = 0,05.56 = 2,8 (g)
=> mCu = 6 - 2,8 = 3,2 (g)
=> D
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn hỗn hợp chứa 16,8 gam Fe và 4,4 gam FeS vào dung dịch H2SO4 loãng, dư, thể tích khí thu được ở đktc sau phản ứng là:
A. 6,72 lít
B. 7,84 lít
C. 5,6 lít
D. 10,08 lít
Hòa tan 6 gam hỗn hợp A gồm Fe và Cu trong dung dịch H2SO4 loãng dư, sau khi phản ứng xảy ra hoàn toàn thu được 1,12 lit khí H2 (đktc) và còn lại m gam chất rắn không tan. Giá trị của m là
Biết Fe =56; Cu==1; S=32; O=16
A.3,2
B.4,8
C.2,8
D.1,6
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
_____0,05<--------------------0,05
=> mFe = 0,05.56 = 2,8 (g)
=> mCu = 6-2,8 = 3,2 (g)
=> A
Đúng 2
Bình luận (0)
Cho 10 gam hỗn hợp X gồm Fe, Cu phản ứng hoàn toàn với dung dịch
H
2
SO
4
loãng dư, sau phản ứng thu được 3,36 lít khí (đktc), dung dịch Y và m gam chất rắn không tan. Giá trị của m là A. 8,4. B. 1,6. C. 5,6. D. 4,4.
Đọc tiếp
Cho 10 gam hỗn hợp X gồm Fe, Cu phản ứng hoàn toàn với dung dịch H 2 SO 4 loãng dư, sau phản ứng thu được 3,36 lít khí (đktc), dung dịch Y và m gam chất rắn không tan. Giá trị của m là
A. 8,4.
B. 1,6.
C. 5,6.
D. 4,4.
Đáp án B
Khí thi được là
![]()
Cu là kim loại đứng sau hiđro trong dãy hoạt động hóa học, do đó Cu không tác dụng với dung dịch H 2 SO 4 loãng => Chất rắn không tan là Cu
Sơ đồ phản ứng:

Đúng 0
Bình luận (0)
Hòa tan hoàn toàn a gam hỗn hợp 2 kim loại Al, Cu trong dung dịch H2SO4 loãng, dư. Sau phản ứng thu được 3,36 lít khí H2 (đktc) và 8 gam chất rắn không tan.
a) Tính a.
b)Tính khối lượng dung dịch H2SO4 20% tối thiểu cần dùng cho phản ứng trên
a) PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2 mol : 3 mol : 1 mol : 3 mol
0,1 mol <-- 0,15 mol <--- 0,15 mol
số mol của H2 là: 3,36 / 22,4 = 0,15 mol
khối lượng Al là: 0,1 * 27 = 2,7 g
ta có: 8 g chất rắn không tan sau phản ứng là: Cu
vậy khối lượng hỗn hợp a là: mAl + mCu = 2,7 + 8 = 10,7 g
b) khối lượng chất tan của H2SO4 là: mchất tan= 0,15 * 98 = 14,7 g
ta có: C% H2SO4= (mchất tan/ m dung dịch) * 100
→ m dung dịch H2SO4 = ( m chất tan * 100) / C% = ( 14,7 * 100) / 20= 73,5 g
Đúng 0
Bình luận (0)
Hòa tan hết 15,2 gam hỗn hợp hai kim loại Fe và Cu trong dung dịch H2SO4 đặc, nóng, dư, thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Mặt khác cho 1,52 gam hỗn hợp vào dung dịch H2SO4 loãng dư thì thể tích khí thoát ra ở đktc là A. 0,672 lít. B. 2,24 lít. C. 0,224 lít. D. 0,448 lít.
Đọc tiếp
Hòa tan hết 15,2 gam hỗn hợp hai kim loại Fe và Cu trong dung dịch H2SO4 đặc, nóng, dư, thu được 6,72 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Mặt khác cho 1,52 gam hỗn hợp vào dung dịch H2SO4 loãng dư thì thể tích khí thoát ra ở đktc là
A. 0,672 lít.
B. 2,24 lít.
C. 0,224 lít.
D. 0,448 lít.
Đáp án C
Trong 15,2 gam hỗn hợp kim loại
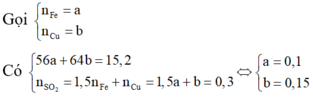
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )
Đúng 0
Bình luận (0)
hòa tan 5.64 gam CU(NO3)2 và 1,7 gam AgNO3 vào nước được 101,43 gam dung dịch A.Cho 1,57 gam hỗn hợp Al ,Zn vào dung dịch A sau phản ứng hoàn toàn thu được dịch dịch D chứa 2 muối và chất rắn B . Cho B tác dụng với dung dịch H2SO4 loãng không có khí thoát ra .Tính nồng độ % các chất trong dung dịch D.
Khj cho B td H2SO4 ko co chat khj thoat ra chung to Al va Zn da pu het.
nCu(NO3)2=0,03=>nCu[+2]=0,03.
nAgNO3=0,01=>nAg+=0,01
goi x,y la so mol Al,Zn.
Al>Al[+3]+3e
Zn>Zn[+2]+2e
=>ne nhuog=3x+2y
Cu[+2]+2e>Cu
Ag+ + 1e>Ag
=>ne nhan=0,03.2+0,01=0,07
theo dlbt e=>3x+2y=0,07
27x+65y=1,57
=>x=0,01,y=0,02
=>nAl(NO3)3=0,01
=>mAl(NO3)3=2,13g
nZn(NO3)2=nZn[+2]=0,02=>mZn(NO3)2=3,78g
khoi luog Cu va Ag la=0,03.64+0,01.108=3g
=>kl dd giam la 3-1,57=1,43
=>kl dd luc sau la 101,43-1,43=100g
=>C%Al(NO3)3=2,13/100=2,13%
C%Zn(NO3)2=3,78%
Đúng 0
Bình luận (1)
hòa tan hoàn toàn 13,45g hỗn hợp X gồm Al, Fe, Cu trong dung dịch H2SO4 0,5M loãng, dư thì thu được 5,6l khí bay ra ở ĐKTC và còn lại 8g phần rắn Y không tan.
A/ tính phần trăm khối lượng mỗi chất ban đầu
B/ tính thể tích dung dịch H2SO4 tham gia phản ứng
a) Y là Cu
$m_{Cu} = 8(gam)$
Gọi $n_{Al} = a(mol) ; n_{Fe} = b(mol)$
Ta có : $27a + 56b + 8 = 13,45(1)$
$2Al + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2$
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$n_{H_2} = 1,5a + b = \dfrac{5,6}{22,4} = 0,25(2)$
Từ (1)(2) suy ra a = 0,15 ; b = 0,025$
$\%m_{Cu} = \dfrac{8}{13,45}.100\% = 59,47\%$
$\%m_{Al} = \dfrac{0,15.27}{13,45}.100\% = 30,11\%$
$\%m_{Fe} = 10,42\%$
b)
$n_{H_2SO_4} = n_{H_2} = 0,25(mol)$
$V_{dd\ H_2SO_4} = \dfrac{0,25}{0,5} = 0,5(lít)$
Đúng 3
Bình luận (0)
Cho 10g hỗn hợp X gồm Fe, Cu phản ứng hoàn toàn với H2SO4 loãng dư, sau phản ứng thu được 3,36 lít khí (đktc), dung dịch Y và m gam chất rắn không tan. Giá trị của m:
A. 8,4
B. 1,6
C. 5,6
D. 4,4
Đáp án B.
Cu không phản ứng với H2SO4 loãng
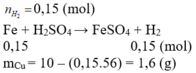
Đúng 0
Bình luận (0)