cho X, Y liên tiếp trong 1 chu kỳ , có tổng đơn vị điện tích hạt nhân =25 . tìm ZX,ZY

Những câu hỏi liên quan
Hai nguyên tố X,Y đứng kế tiếp nhau trong một chu kì thuộc bảng tuần hoàn có tổng điện tích dương trong hạt nhân là 25. Vị trí của X và Y trong bảng tuần hoàn là (biết
Z
x
Z
y
) A. X chu kì 3, nhóm IIA, Y chu kì 2, nhóm IIIA. B. X chu kì 3, nhóm IIA, Y chu kì 3, nhóm IIIA. C. X chu kì 2, nhóm IIIA, Y chu kì 3 nhóm IIIA. D. tất cả đều sai.
Đọc tiếp
Hai nguyên tố X,Y đứng kế tiếp nhau trong một chu kì thuộc bảng tuần hoàn có tổng điện tích dương trong hạt nhân là 25. Vị trí của X và Y trong bảng tuần hoàn là (biết Z x < Z y )
A. X chu kì 3, nhóm IIA, Y chu kì 2, nhóm IIIA.
B. X chu kì 3, nhóm IIA, Y chu kì 3, nhóm IIIA.
C. X chu kì 2, nhóm IIIA, Y chu kì 3 nhóm IIIA.
D. tất cả đều sai.
Cho hay nguyên tố X, Y (
Z
X
Z
Y
) đứng kế tiếp nhau trong bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân là 37. Khẳng định nào sau đây là đúng? A. X, Y thuộc cùng một chu kì. B. X là phi kim, Y là kim loại. C. X có 4 lớp electron. D. Y thuộc nhóm IA.
Đọc tiếp
Cho hay nguyên tố X, Y ( Z X < Z Y ) đứng kế tiếp nhau trong bảng tuần hoàn và có tổng số đơn vị điện tích hạt nhân là 37. Khẳng định nào sau đây là đúng?
A. X, Y thuộc cùng một chu kì.
B. X là phi kim, Y là kim loại.
C. X có 4 lớp electron.
D. Y thuộc nhóm IA.
Có hai nguyên tố X, Y thuộc cùng một nhóm và ở hai chu kì liên tiếp, tổng số điện tích hạt nhân của X và Y là 58. Biết rằng
Z
X
Z
Y
. X là A.
M
25
n
B.
A
33
s
C.
A
13
l
D.
C...
Đọc tiếp
Có hai nguyên tố X, Y thuộc cùng một nhóm và ở hai chu kì liên tiếp, tổng số điện tích hạt nhân của X và Y là 58. Biết rằng Z X < Z Y . X là
A. M 25 n
B. A 33 s
C. A 13 l
D. C 20 a
cho hai nguyên tố X Y nằm ở hai chu kỳ liên tiếp thuộc cùng một nhóm A trong bảng tuần hoàng và có tổng điện tích hạt nhân là 32
- xác định điện tích hạt nhân của X Y
- cấu hình electrong X,Y
- vị trí trong bng3 tuần hoàn , tính chất
-so sánh tính kim loại / phi kim và tính acid / base của X Y
X,Y liên tiếp thuộc cùng 1 chu kì trong bảng htth, tổng số đơn vị điện tích hạt nhân là 25
a. xác định số p, e, đthn
b. xác định tính chất hóa học và so sánh tính chất hóa học đó
CỨU EM VỚI Ạ
a) Có \(\left\{{}\begin{matrix}p_X+p_Y=25\\p_Y-p_X=1\end{matrix}\right.=>\left\{{}\begin{matrix}p_X=12\\p_Y=13\end{matrix}\right.\)
=> pX = eX = 12; đthn của X là 12+
=> pY = eY = 13; đthn của Y là 13+
b)
- Cấu hình của X: 1s22s22p63s2
X có 2e lớp ngoài cùng => X có tính chất của kim loại
- Cấu hình của Y: 1s22s22p63s23p1
Y có 3e lớp ngoài cùng => Y có tính chất của kim loại
- Do trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố giảm dần
=> X có tính kim loại mạnh hơn Y
Đúng 3
Bình luận (1)
X và Y là 2 nguyên tố thuộc hai chu kỳ liên tiếp nhau trong cùng một nhóm A của bảng tuần hoàn, X có điện tích hạt nhân nhỏ hơn Y. Tổng số proton trong hạt nhân nguyên tử của X và Y là 32. X, Y là A. Na(Z11) và K(Z19). B. Si(Z14) và Ar(Z18). C. Al(Z13) và K(Z19). D. Mg(Z12) và Ca(Z20).
Đọc tiếp
X và Y là 2 nguyên tố thuộc hai chu kỳ liên tiếp nhau trong cùng một nhóm A của bảng tuần hoàn, X có điện tích hạt nhân nhỏ hơn Y. Tổng số proton trong hạt nhân nguyên tử của X và Y là 32. X, Y là
A. Na(Z=11) và K(Z=19).
B. Si(Z=14) và Ar(Z=18).
C. Al(Z=13) và K(Z=19).
D. Mg(Z=12) và Ca(Z=20).
Đáp án D
Hai nguyên tố thuộc cùng một nhóm A, thuộc hai chu kỳ liên tiếp = Điện tích hạt nhân cách nhau 8, 18 hay 32
Trường hợp 1:
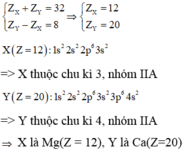
Trường hợp 2:
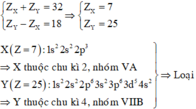
Trường hợp 3:
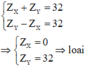
Đúng 0
Bình luận (0)
X và Y (ZX ZY) là hai nguyên tố thuộc cùng một nhóm A và hai chu kỳ liên tiếp trong bảng tuần hoàn. Tổng số hạt proton của hai nguyên tử hai nguyên tố đó là 22. Nhận xét đúng về X, Y là: A. Đơn chất của X tác dụng được với đơn chất của Y B. Độ âm điện của Y lớn hơn độ âm điện của X C. Hợp chất của X với hiđro là phân tử phản cực D. Công thức oxit cao nhất của Y là YO2
Đọc tiếp
X và Y (ZX < ZY) là hai nguyên tố thuộc cùng một nhóm A và hai chu kỳ liên tiếp trong bảng tuần hoàn. Tổng số hạt proton của hai nguyên tử hai nguyên tố đó là 22. Nhận xét đúng về X, Y là:
A. Đơn chất của X tác dụng được với đơn chất của Y
B. Độ âm điện của Y lớn hơn độ âm điện của X
C. Hợp chất của X với hiđro là phân tử phản cực
D. Công thức oxit cao nhất của Y là YO2
Chọn C.
Vì số proton trong Y lớn hơn trong X 8 hạt nên ta tìm được X là N (Z = 7) và Y là P (Z= 15).
Đúng 0
Bình luận (0)
x,y (zx<zy) là 2nguyeen tố thuộc cùng một nhóm và 2chu kì liên tiếp tổng số protron trong hạt của x, y bằng 30 tìm vị trí của x,y
PX+PY=30 (1)
Mà X,Y cùng nhóm thuộc 2 chu kì liên tiếp
=> PY - PX=8 (ZX < ZY) (2)
(1) , (2) => PX=ZX=11; PY=ZY=19
=>X: Natri ; Y: Kali
X: Ô số 11, chu kì 3, nhóm IA
Y: Ô số 19, chu kì 4, nhóm IA
Đúng 2
Bình luận (1)
X và Y là hai nguyên tố thuộc cùng nhóm A, ở hai chu kì liên tiếp,
Z
X
Z
Y
và Y là nguyên tố thuộc chu kì lớn của bảng tuần hoàn. Biết rằng tổng số hạt proton, nơtron, electron trong X và Y là 156, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36. X là A. As B. P C. O D. Ca
Đọc tiếp
X và Y là hai nguyên tố thuộc cùng nhóm A, ở hai chu kì liên tiếp, Z X < Z Y và Y là nguyên tố thuộc chu kì lớn của bảng tuần hoàn. Biết rằng tổng số hạt proton, nơtron, electron trong X và Y là 156, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 36. X là
A. As
B. P
C. O
D. Ca
B
X và Y là hai kim loại cùng nhóm A.
=> Y có nhiều hơn X là 8 hoặc 18 hoặc 32 electron.
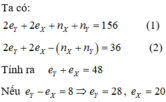
(không thuộc 2 chu kì)(loại).
![]()
Vậy 2 nguyên tố này là As và P, cùng thuộc nhóm VA và thuộc 2 chu kì (nhận).
![]()
(không thuộc 2 chu kì liên tiếp) (loại).
Vậy X là photpho (P).
Đúng 0
Bình luận (0)












