Dẫn V lít CO2(đktc) vào 400ml dung dịch Ca(OH)2 0,5M thu được dung dịch A và 10g chất rắn không tan. Lọc kết tủa, nung dung dịch A lại thấy xuất hiện kết tủa
a) Xác định khối lượng các chất tạo thành trong phản ứng của CO2 và Ca(OH)2
b) Tìm V
dẫn V lít khí CO2 (đktc) vào 400ml dung dịch Ca(oh)2 0,5 M thu được dung dịch A và 10 g chất rắn không tan . Lọc kết tủa ,nung nóng dd A lại xuất hiện kết tủa
a) Xác đinh khối lượng các chất tạo thành trong phản ứng của co2 và ca(oh)2
b) tìm V
Ta có: n(Ca(OH)2) = 0.2 mol, n ( Chất rắn) = 0,1 mol.
PTHH: CO2 + Ca(OH)2 => CaCO3 (kết tủa) + H2O
0,2 <= 0,2 => 0,2 (mol)
vì 0,2 > 0,1 nên xảy ra 2 phản ứng sau (CO2 dư)
PTHH: CO2 + Ca(OH)2 => CaCO3 (kết tủa) + H2O
0,2 <= 0,2 => 0,2 (mol)
CO2 + CaCO3 + H2O => Ca(HCO3)2
0,1 <= 0,1 => 0,1 (mol)
Ca(HCO3)2 (t độ)=> CaCO3( kết tủa) + H2O
0,1 => 0,1 (mol)
a) các khối lượng có số mol hết r bn tự tính giùm mik nha
b) n ( CO2) = n (CO2 1) +n (CO2 2) = 0,2 + 0,1 = 0,3 (mol)
V (CO2) = n (CO2) * 22,4 = 0,3 * 22,4 =6,72 (l)
Thổi 7,84 lít khí CO2 (đktc) vào dung dịch Ca(OH)2 dư thu được kết tủa X và dung dịch Y. Lọc toàn bộ lượng kết tủa ra khỏi dung dịch, sau đó nung đến khối lượng không đổi thu được chất rắn Z có khối lượng m. Tìm m.
A. 19,6 gam.
B. 35 gam.
C. 56,7 gam.
D. 20 gam.
\(n_{CO_2}=\dfrac{7.84}{22.4}=0.35\left(mol\right)\)
Bảo toàn C :
\(n_{CO_2}=n_{CaCO_3}=0.35\left(mol\right)\)
Bảo toàn Ca :
\(n_{CaO}=n_{CaCO_3}=0.35\left(mol\right)\)
\(m_{CaO}=0.35\cdot56=19.6\left(g\right)\)
Cho hỗn hợp X gồm Ba và Al2O3 vào nước dư thu được dung dịch Y và 1,344 lít khí H2 (đktc). Nhỏ từ từ đến hết 40ml dung dịch HCl 0,5M vào Y thì thấy trong Y bắt đầu xuất hiện kết tủa. Nếu thêm tiếp vào đó 360ml dung dịch H2SO4 0,5M rồi lọc lấy kết tủa đem nung đến khối lượng không đổi thì thu được chất rắn có khối lượng là
A. 14,66 gam
B. 15,02 gam
C. 13,98 gam
D. 12,38 gam
Câu 1. Nhiệt phân hoàn toàn một lượng muối khan A trong ống sứ thu được 0,4g chất rắn là oxit kim loại. Chất khí thoát ra khỏi ống được hấp thụ hoàn toàn trong 50g dung dịch KOH 2,24% thu được 50,44g dung dịch B chứa chất tan duy nhất là muối trung hòa có nồng độ xấp xỉ 2,736%. Xác định công thức hóa học của A, biết rằng kim loại trong A có hóa trị không đổi là 2y/x.
Câu 2. Có một loại đá vôi chứa 80% là CaCO3, còn lại là tạp chất trơ. Nung 50g đá vôi này sau một thời gian thu được chất rắn X và V lít khí Y. Dẫn toàn bộ khí Y sục từ từ vào 600g dung dịch Ba(OH)2 11,4% thấy xuất hiện 59,1g kết tủa.
a) Tính V
b) Tính % về khối lượng của CaO có trong chất rắn X.
c) Tính hiệu suất phản ứng phân hủy.
Câu 3. Lấy một lượng dung dịch H2SO4 20%, đun nóng để hòa tan vừa đủ 64g CuO. Sau phản ứng làm nguội dung dịch về 20oC. Tính khối lượng tinh thể CuSO4.5H2O tách ra khỏi dung dịch. Biết độ tan của CuSO4 ở 20oC là 25g.
Câu 4. Trộn m gam hỗn hợp hai kim loại Mg, Fe với 16g bột lưu huỳnh được hỗn hợp X. Nung X trong bình kín không có không khí tỏng một thời gian thu được hỗn hợp Y. Hòa tan hết Y trong dung dịch H2SO4 đặc nóng dư thấy có 44,8 lít khí SO2 (đktc) thoát ra. Dung dịch thu được cho tác dụng với dung dịch NaOH dư thấy xuất hiện kết tủa. Lọc lấy kết tủa, đem nung đến khối lượng không đổi thu được 24g chất rắn. Tính m và thành phần % về khối lượng từng kim loại trong hỗn hợp ban đầu.
Câu 5. Hòa tan 10g CuO bằng dung dịch H2SO4 19,6% vừa đủ thu được dung dịch A. Làm lạnh dung dịch A thấy có 12,5g tinh thể X tách ra, phần dung dịch còn lại có nồng độ 20%. Tìm công thức háo học của tinh thể X?
Câu 6. Cho 16,1g hỗn hợp X1 gồm Zn, Cu vào 400ml dung dịch AgNO3 1M. Sau khi phản ứng xảy ra hoàn toàn thu được 46,4g chất rắn X2. Tính khối lượng từng chất trong X1, X2 ?
Câu 7. Dẫn 22,4 lít khí CO ( đktc) qua 46,4g một oxit kim loại, nung nóng thu được kim loại M và hỗn hợp khí X có tỉ khối so với H2 bằng 20,4. Xác định công thức hóa học của oxit kim loại M.
Câu 8. Nung nóng 11,6g hỗn hợp kim loại gồm Al, Zn và kim loại A có hóa trị II không tan trong nước, thu được 14,8g hỗn hợp chất rắn X. Hòa tan hết X trong V lít dung dịch HCl 2M vừa đủ thấy tạo ra 4,48 lít H2 (đktc).
a) Viết các phương trình phản ứng
b) Tính V và khối lượng muối clorua sinh ra?
Câu 9. Dẫn V lít khí CO2 (đktc) vào 2 lít dung dịch A chứa KOH 1M, Ca(OH)2 0,05M thu được 8g kết tủa. Tính giá trị của V (coi các phản ứng xảy ra hoàn toàn).
em đang cần gấp ạ, mọi người giúp em với, em cám ơn :>
3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)
Cho hỗn hợp X gồm Ba và Al2O3 vào nước dư thu được dung dịch Y và 1,344 lít khí H2 (đktc). Nhỏ từ từ đến hết 40 ml dung dịch HCl 0,5M vào Y thì thấy trong Y bắt đầu xuất hiện kết tủa. Nếu thêm tiếp vào đó 360 ml dung dịch H2SO4 0,5M rồi lọc lấy kết tủa đem nung đến khối lượng không đổi thì thu được chất rắn có khối lượng là:
A. 14,66 gam
B. 15,02 gam
C. 13,98 gam
D. 12,38 gam
Đáp án A
Bài 21. Giải:
• X + nước dư → dung dịch Y + H2
=> Chứng tỏ X tan hết.
• Có n Ba = n H 2 = 1 , 344 22 , 4 = 0 , 06 mol
• Nhỏ từ từ đến 0,02 mol HCl thì thấy bắt đầu xuất hiện kết tủa, tức là OH - phản ứng vừa hết.
⇒ n OH - = 0 , 02 mol ⇒ n AlO 2 - = 0 , 06 . 2 - 0 , 02 = 0 , 1 mol
• Thêm 0,18 mol H2SO4:
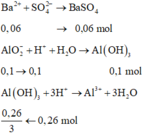
• Lọc kết tủa, nung đến khối lượng không đổi được:
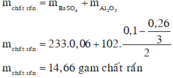
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 (loãng, lấy dư) thu được dung dịch A. Cho dung dịch A tác dụng với dung dịch NaOH dư thu được dung dịch B và kết tủa D. Nung D trong không khí ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn E. Thổi luồng khí CO (lấy dư) qua ống sứ chứa E nung nóng (ở 700–800oC) cho đến khi phản ứng hoàn toàn thu được chất rắn G và khí X. Sục khí X vào dung dịch Ca(OH)2 thì thu được kết tủ a Y và dung dịch Z. Lọc bỏ Y, đun nóng dung dịch Z lại tạo được kết tủa Y. Xác định thành phần A, B, D, E, G, X, Y, Z và viết các phương trình hóa học xảy ra
Phương trình:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2↓
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
2Fe(OH)2 + ½ O2 → Fe2O3 + 2H2O
2Fe(OH)3 → Fe2O3 + 3H2O
Fe2O3 + 3CO → 2Fe + 3CO2↑
CO2 + Ca(OH)2 → CaCO3↓ + H2O
3CO2 + Ca(OH)2 → Ca(HCO3)2
Ca(HCO3)2 → CaCO3 + CO2↑ + H2O
Đốt cháy hoàn toàn 4,3 gam một chất hữu cơ X thu được hỗn hợp khí CO2, H2O, HCl. Dẫn hỗn hợp này vào bình đựng dung dịch AgNO3 dư, thu được 5,74 gam kết tủa và khối lượng bình dung dịch AgNO3 tăng thêm 2,54 gam. Khí thoát ra khỏi bình dung dịch AgNO3 dẫn vào 5 lít dung dịch Ca(OH)2 0,02M (TN1) thấy xuất hiện kết tủa, lọc tách kết tủa, dung dịch còn lại cho tác dụng với dung dịch Ba(OH)2 dư (TN2) lại thấy xuất hiện thêm kết tủa, tổng khối lượng kết tủa ở 2 thí nghiệm là 13,94 gam. Biết Mx < 230 gam/mol. Số nguyên tử O trong một phân tử của X là
A. 2
B. 4
C. 1
D. 3.
Hòa tan hoàn toàn m gam hỗn hợp rắn A gồm Al, Mg và Fe2O3 trong V lít dung dịch HNO3 0,5M. Sau phản ứng thu được dung dịch B và 0,672 lít (đktc) hỗn hợp khí D gồm 2 khí không màu, không hóa nâu trong không khí có tỉ khối so với H2 là 14,8. Đem dung dịch B tác dụng với NaOH dư thu được dung dịch C và kết tủa E nặng 47,518 gam. Đem lọc kết tủa E nung trong không khí đến khối lượng không đổi thu được 38,92 gam chất rắn F. Để hòa tan hết F cần dùng 1,522 lít dung dịch HCl 1M. Sục CO2 dư vào dung dịch C thu được 13,884 gam kết tủa trắng. Khối lượng muối có trong B là
A. 148,234
B. 167,479
C. 128,325
D. 142,322
Thổi V lít khí CO2 (đktc) vào 100ml dung dịch Ca(OH)2 1M thu được 6 gam kết tủa X và dung dịch Y. Lọc toàn bộ kết tủa, sau đó đun nóng dung dịch Y lại thấy xuất hiện kết tủa nữa. Tìm V?
A. 1,12 lít.
B. 2,24 lít.
C. 3,136 lít.
D. 3,36 lít.
Đổi: \(100ml=0,1l\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\left(1\right)\)
0,06 0,06 0,06 (mol)
\(2CO_2+Ca\left(OH\right)_2\rightarrow Ca\left(HCO_3\right)_2\left(2\right)\)
0,08 0,04 (mol)
\(n_{Ca\left(OH\right)_2}=1.0,1=0,1\left(mol\right)\)
\(n_{CaCO_3}=\dfrac{m}{M}=\dfrac{6}{100}=0.06\left(mol\right)\)
\(n_{Ca\left(OH\right)_2\left(2\right)}=0,1-0,06=0,04\left(mol\right)\)
\(\Rightarrow n_{CO_2}=0,06+0,04.2=0,14\left(mol\right)\)
\(\Rightarrow V_{CO_2}=n_{CO_2}.22,4=0,14.22,4=3,136\left(l\right)\)