cho 4,48 lít khí (điều kiện tiêu chuẩn) hỗn hợp khí N2O và CO2 từ từ qua bình đựng nước vôi trong dư thấy có 1,12 lít khí (điều kiện tiêu chuẩn) khí thoát ra . thành phần phần trăm về khối lượng của từng khí trong hỗn hợp là bao nhiêu ?

Những câu hỏi liên quan
cho 4,48 lít khí (điều kiện tiêu chuẩn) hỗn hợp khí N2O và CO2 từ từ qua bình đựng nước vôi trong dư thấy có 1,12 lít khí (điều kiện tiêu chuẩn) khí thoát ra . thành phần phần trăm về khối lượng của từng khí trong hỗn hợp là bao nhiêu ?
cho 4,48 lít khí (điều kiện tiêu chuẩn) hỗn hợp khí N2O và CO2 từ từ qua bình đựng nước vôi trong dư thấy có 1,12 lít khí (điều kiện tiêu chuẩn) khí thoát ra . thành phần phần trăm về khối lượng của từng khí trong hỗn hợp là bao nhiêu ?
cho 4,48 lít khí (điều kiện tiêu chuẩn) hỗn hợp khí N2O và CO2 từ từ qua bình đựng nước vôi trong dư thấy có 1,12 lít khí (điều kiện tiêu chuẩn) khí thoát ra . thành phần phần trăm về khối lượng của từng khí trong hỗn hợp là bao nhiêu ?
Cho 4,48 lít khí gồm metan và etilen đi qua dung dịch brom dư, thấy dung dịch nhạt màu và còn 1,12 lít khí thoát ra. Các thể tích khí đo ở điều kiện tiêu chuẩn. Thành phần phần trăm thể tích của khí metan trong hỗn hợp là:
A. 25% ; B. 50% ; C. 60% ; D. 37,5%
Hãy chọn đáp án đúng
- Đáp án A
- Khi cho hỗn hợp khí (gồm CH4 và C2H4 ) đi qua dung dịch brom thì C2H4 sẽ phản ứng hết với dung dịch brom, CH4 không tác dụng sẽ đi ra khỏi bình.
Đúng 0
Bình luận (0)
Dẫn 4,48 lít hỗn hợp khí gồm
N
2
v
à
C
l
2
vào dung dịch
C
a
O
H
2
dư. Sau khi phản ứng xảy ra hoàn toàn, còn lại 1,12 lít khí thoát ra. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Thành phần phần trăm thể tích của
C
l
2...
Đọc tiếp
Dẫn 4,48 lít hỗn hợp khí gồm N 2 v à C l 2 vào dung dịch C a O H 2 dư. Sau khi phản ứng xảy ra hoàn toàn, còn lại 1,12 lít khí thoát ra. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Thành phần phần trăm thể tích của C l 2 trong hỗn hợp trên là
A. 88,38%
B. 75,00%
C. 25,00%
D. 11,62%
Chọn đáp án B
Khí thoát ra là N 2 không phản ứng.
% V c l o = 4 , 48 - 1 , 12 4 , 48 . 100 % =75%
Đúng 0
Bình luận (0)
Ở điều kiện tiêu chuẩn 3,36 lít hỗn hợp khí gồm CH4 và C2H4 có khối lượng 3 gam A Tính phần trăm theo thể tích và theo khối lượng mỗi khí trong hỗn hợp B Dẫn 3,36 lít hỗn hợp khí trên qua bình chứa dung dịch brom dư thấy dung dịch Brom bị nhạt màu và khối lượng tăng thêm M gam. Tính m
a, Ta có: \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
\(16n_{CH_4}+28n_{C_2H_4}=3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,1\left(mol\right)\\n_{C_2H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%\approx53,33\%\\\%m_{C_2H_4}\approx46,67\%\end{matrix}\right.\)
- Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%\approx66,67\%\\\%V_{C_2H_4}\approx33,33\%\end{matrix}\right.\)
b, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Có: m tăng = mC2H4 = 0,05.28 = 1,4 (g)
Đúng 1
Bình luận (0)
a) \(n_{hh}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,15\\16a+28b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%=53,33\%\\\%m_{C_2H_4}=100\%-53,33\%=46,67\%\end{matrix}\right.\)
b) \(m=m_{C_2H_4}=0,05.28=1,4\left(g\right)\)
Đúng 2
Bình luận (0)
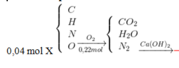
Đốt cháy hoàn toàn 0,04 mol hợp chất X cần vừa đủ 24,64 lít không khí đo ở điều kiện tiêu chuẩn. Hấp thụ hoàn toàn sản phẩm cháy qua bình đựng nước vôi trong thu được 8 gam kết tủa và khối lượng bình tăng thêm 10,64 gam , thoát ra 20,608 lít khí đo ở điều kiện tiêu chuẩn. Thêm tiếp dung dịch NaOH dư vào bình sau phản ứng thấy tạo thêm 4 gam kết tủa. Công thức phân tử của hợp chất hữu cơ: A. C3H9O2N B. C4H10O2N2 C. C4H10O2N D. C3H10O2N.
Đọc tiếp
Đốt cháy hoàn toàn 0,04 mol hợp chất X cần vừa đủ 24,64 lít không khí đo ở điều kiện tiêu chuẩn. Hấp thụ hoàn toàn sản phẩm cháy qua bình đựng nước vôi trong thu được 8 gam kết tủa và khối lượng bình tăng thêm 10,64 gam , thoát ra 20,608 lít khí đo ở điều kiện tiêu chuẩn. Thêm tiếp dung dịch NaOH dư vào bình sau phản ứng thấy tạo thêm 4 gam kết tủa. Công thức phân tử của hợp chất hữu cơ:
A. C3H9O2N
B. C4H10O2N2
C. C4H10O2N
D. C3H10O2N.
Dẫn 3,36 lít hỗn hợp khí A gồm CH4 và C2H2 qua dd brom thấy có 1,12 lít khí không màu thoát ra. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A ( biết khí đo ở nhiệt độ tiêu chuẩn).
Khí thoát ra ngoài : $CH_4$
$C_2H_2 + 2Br_2 \to C_2H_2Br_4$
$V_{CH_4} = 1,12(lít) \Rightarrow \%V_{CH_4} = \dfrac{1,12}{3,36}.100\% = 33,33\%$
$\%V_{C_2H_2} = 100\% -33,33\% = 66,67\%$
Đúng 4
Bình luận (0)
Một hỗn hợp A gồm etan (C2H6), etilen, axetilen, hiđro. Tỉ khối của hỗn hợp A so với CO2 là 0,4. Cho 11,2 lít hỗn hợp A đi qua dung dịch Br2 dư thấy khối lượng bình Br2 tăng thêm m gam. Hỗn hợp khí B thoát ra khỏi bình Br2 có thể tích 6,72 lít, trong đó khí có khối lượng phân tử nhỏ hơn chiếm 11,765% về khối lượng. Biết các phản ứng xảy ra hoàn toàn và các thể tích khí đo ở điều kiện tiêu chuẩn. a. Viết các phương trình hóa học xảy ra. b. Tính phần trăm thể tích các khí trong B. c. Tính m gam...
Đọc tiếp
Một hỗn hợp A gồm etan (C2H6), etilen, axetilen, hiđro. Tỉ khối của hỗn hợp A so với CO2 là 0,4. Cho 11,2 lít hỗn hợp A đi qua dung dịch Br2 dư thấy khối lượng bình Br2 tăng thêm m gam. Hỗn hợp khí B thoát ra khỏi bình Br2 có thể tích 6,72 lít, trong đó khí có khối lượng phân tử nhỏ hơn chiếm 11,765% về khối lượng. Biết các phản ứng xảy ra hoàn toàn và các thể tích khí đo ở điều kiện tiêu chuẩn.
a. Viết các phương trình hóa học xảy ra.
b. Tính phần trăm thể tích các khí trong B.
c. Tính m gam.
a. Phương trình phản ứng :
C2H2 + 2Br2 → C2H2Br4 (1)
C2H4 + Br2 → C2H4Br2 (2)
b. Hỗn hợp khí B gồm có H2, C2H6. Gọi x, y ( mol ) lần lượt là số mol của H2 và C2H6 có trong 6,72 lít hỗn hợp B.
nB = x + y = 6,72 : 22,4 = 0,3 mol (I)
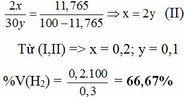
% V(C2H6) = 100% – 66,67% = 33,33%
c. nA = 11,2 : 22,4 = 0,5 mol , M A = 0,4 . 44 = 17,6 g/ mol
mA = 0,5 . 17,6 = 8,8 gam
mB = 0,2 . 2 + 0,1 . 30 = 3,4 gam
Vậy khối lượng bình Br2 tăng: m = mA – mB = 8,8 – 3,4 = 5,4 gam.
Đúng 0
Bình luận (0)