Ngâm một thanh sắt trong dung dịch có chứa 3,2 gam muối sunfat của kim loại hóa trị 2 .sau phản ứng thanh sắt tăng thêm 0,14 gam .Hãy xác định công thức hóa học của muối sunfat.

Những câu hỏi liên quan
Ngâm một lá sắt có khối lượng 50 gam trong 200 gam dung dịch muối sunfat của kim loại m hóa trị 2 nồng độ 16% sau khi toàn bộ mùa xuân Pháp đã phản ứng hết lấy lá sắt ra rửa nhẹ làm khô căng lại thấy khối lượng tăng 3,2% so với ban đầu. Xác định công thức hóa học muối sunfat của kim loại m
Bạn tham khảo nhá!!!
mCuSO4 = = = 32 (gam)
nCuSO4 = = 0,2 (mol)
Gọi x là khối lượng miếng sắt ban đầu.
Khối lượng miếng sắt sau khi nhúng vào dung dịch CuSO4 tăng là:
= 0,08.x (gam)
Fe + CuSO4 ---> FeSO4 + Cu
1mol 1mol 1mol 1mol
0,2mol 0,2mol 0,2mol 0,2mol
Khối lượng sắt phản ứng: 0,2.56 = 11,2 (gam)
Khối lượng Cu sinh ra: 0,2.64 = 12,8 (gam)
Khối lượng miếng sắt tăng lên = mCu sinh ra - mFe phản ứng
=> 0,08.x = 12,8 – 11,2
0,08.x = 1,6 => x = 20 (gam)
Vậy khối lượng miếng sắt ban đầu là 20 gam
Đúng 0
Bình luận (1)
Ngâm một thanh sắt vào dung dịch chứa 9,6 gam muối sunfat của kim loại hóa trị II, sau khi kết thúc phản ứng thanh sắt tăng thêm 0,48 gam. Vậy công thức hóa học của muối sunfat là:
A. CuSO4
B. CdSO4
C. NiSO4
D. ZnSO4
Ngâm một lá kẽm trong dung dịch muối sunfat có chứa 4,48 gam ion kim loại X điện tích 2+. Sau phản ứng, khối lượng lá kẽm tăng thêm 1,88 gam. Công thức hóa học của muối sunfat đó là: A. CdSO4 B. CuSO4 C. NiSO4 D. FeSO4
Đọc tiếp
Ngâm một lá kẽm trong dung dịch muối sunfat có chứa 4,48 gam ion kim loại X điện tích 2+. Sau phản ứng, khối lượng lá kẽm tăng thêm 1,88 gam. Công thức hóa học của muối sunfat đó là:
A. CdSO4
B. CuSO4
C. NiSO4
D. FeSO4
Đáp án A
Khối lượng kẽm tăng lên chính bằng chênh lệch giữa khối lượng kẽm tan ra và kim loại X bám vào
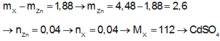
Đúng 0
Bình luận (0)
Câu 1: Cho 325 gam sắt clorua (chưa biết hóa trị) tác dụng với dung dịch AgNOз dư, thu được 8,61 gam kết tủa. Xác định công thức xỉa muối sắt clorua.
Câu 2: Ngâm một lá kẽm trong 20 gam dung dịch muối đồng sunfat 10% cho đến khi phản ứng kết thúc. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng.
Câu 3: Cho 5,6 gam Fe tác dụng với 100ml dung dịch HCl 1M. Thể tích khí Hշ thu được (đktc) là?
Đọc tiếp
Câu 1: Cho 325 gam sắt clorua (chưa biết hóa trị) tác dụng với dung dịch AgNOз dư, thu được 8,61 gam kết tủa. Xác định công thức xỉa muối sắt clorua. Câu 2: Ngâm một lá kẽm trong 20 gam dung dịch muối đồng sunfat 10% cho đến khi phản ứng kết thúc. Tính khối lượng kẽm đã phản ứng với dung dịch trên và nồng độ phần trăm của dung dịch sau phản ứng. Câu 3: Cho 5,6 gam Fe tác dụng với 100ml dung dịch HCl 1M. Thể tích khí Hշ thu được (đktc) là?
Câu 3:
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right);n_{HCl}=0,1.1=0,1\left(mol\right)\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ Vì:\dfrac{0,1}{1}>\dfrac{0,1}{2}\Rightarrow Fe.dư\\ n_{H_2}=\dfrac{n_{HCl}}{2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\)
Đúng 2
Bình luận (0)
Câu 1:
\(Đặt:FeCl_x\) (x: nguyên dương, x hoá trị của Fe)
\(FeCl_x+xAgNO_3\rightarrow xAgCl\downarrow+Fe\left(NO_3\right)_x\\ n_{AgCl}=\dfrac{8,61}{143,5}=0,06\left(mol\right)\\ n_{FeCl_x}=\dfrac{0,06}{x}\left(mol\right)\\ M_{FeCl_x}=\dfrac{3,25}{\dfrac{0,06}{x}}=\dfrac{3,25x}{0,06}\left(\dfrac{g}{mol}\right)\)
Xét x=1;x=2;x=3;x=4, ta thấy có lúc x=3 thì\(M_{FeCl_3}=162,5\left(\dfrac{g}{mol}\right)\)
Vậy nhận x=3 => CTHH FeCl3
Đúng 2
Bình luận (0)
Câu 2:
\(n_{CuSO_4}=\dfrac{20.10\%}{160}=0,0125\left(mol\right)\\ Zn+CuSO_4\rightarrow ZnSO_4+Cu\\ n_{Zn}=n_{Cu}=n_{ZnSO_4}=n_{CuSO_4}=0,0125\left(mol\right)\\ m_{Zn}=0,0125.65=0,8125\left(g\right)\\ m_{ddZnSO_4}=0,8125+20-0,0125.64=20,0125\left(g\right)\\ C\%_{ddZnSO_4}=\dfrac{0,0125.161}{20,0125}.100\%\approx10,056\%\)
Đúng 1
Bình luận (0)
Xem thêm câu trả lời
Một muối được tạo bởi kim loại hóa trị II và phi kim hóa trị I. Hòa tan m gam muối này vào nước và chia dung dịch làm hai phần bằng nhau:- Phần I: Cho tác dụng với dung dịch
A
g
N
O
3
có dư thì được 2,87 gam kết tủa.- Phần II : Nhúng một thanh sắt vào dung dịch muối, sau một thời gian phản ứng kết thúc khối lượng thanh sắt tăng lên 0,08 gam.Tìm công thức phân tử của muối.
Đọc tiếp
Một muối được tạo bởi kim loại hóa trị II và phi kim hóa trị I. Hòa tan m gam muối này vào nước và chia dung dịch làm hai phần bằng nhau:
- Phần I: Cho tác dụng với dung dịch A g N O 3 có dư thì được 2,87 gam kết tủa.
- Phần II : Nhúng một thanh sắt vào dung dịch muối, sau một thời gian phản ứng kết thúc khối lượng thanh sắt tăng lên 0,08 gam.
Tìm công thức phân tử của muối.
Trong giờ thực hành hóa học, một học sinh nhúng một đinh sắt vào dung dịch muối đồng sunfat
C
u
S
O
4
. Sau một thời gian, lấy đinh sắt ra khỏi dung dịch muối. Thanh sắt bị phủ một lớp màu đỏ gạch và dung dịch có muối sắt (II) sunfat
F
e
S
O
4
. Hãy cho biết phản ứng trên thuộc loại phản ứng nào?
Đọc tiếp
Trong giờ thực hành hóa học, một học sinh nhúng một đinh sắt vào dung dịch muối đồng sunfat C u S O 4 . Sau một thời gian, lấy đinh sắt ra khỏi dung dịch muối. Thanh sắt bị phủ một lớp màu đỏ gạch và dung dịch có muối sắt (II) sunfat F e S O 4 . Hãy cho biết phản ứng trên thuộc loại phản ứng nào?
trộn 100g dung dịch chứa muối sunfat của kim loại kiềm nồng độ 13,2% với 100g dung dịch NaHCO3 4,2%..sau phản ứng thu được dung dịch A có khối lượng là m gam (m200g)..cho 100g dung dịch BaCl2 20,8% vào dung dịch A ,, sau khi phản ứng xong vẫn thấy dư dung dịch muối sunfat .. lại thêm 20g dung dịch BaCl2 20,8% nữa thì lại dư BaCl2 và lúc này được dung dịch D..hãy xác định công thức hóa học muối sunfat của kim loại kiềm ban đầu
Đọc tiếp
trộn 100g dung dịch chứa muối sunfat của kim loại kiềm nồng độ 13,2% với 100g dung dịch NaHCO3 4,2%..sau phản ứng thu được dung dịch A có khối lượng là m gam (m<200g)..cho 100g dung dịch BaCl2 20,8% vào dung dịch A ,, sau khi phản ứng xong vẫn thấy dư dung dịch muối sunfat .. lại thêm 20g dung dịch BaCl2 20,8% nữa thì lại dư BaCl2 và lúc này được dung dịch D..hãy xác định công thức hóa học muối sunfat của kim loại kiềm ban đầu
. Do trộn 100g với 100g mà lượng dung dịch thu được < 200g thì muối sunfat kim loại là muối axit.( do sự thất thoát khí )
pt : 2MHSO4 + 2NaHCO3 = M2SO4 + Na2SO4 + 2CO2 + 2H2O
Sự thoát khí CO2 làm giảm khối lượng ( số mol CO2 = số mol NaHCO3 0,05mol)
gọi số mol của MHSO4 là x ta có:
(M + 97) x = 13,2 => x = 13,2/ (M + 97)
Theo phương trình sự tạo kết tủa với BaCl2 là muối sunfat:
MNaSO4 + BaCl2 = BaSO4 + MCl + NaCl
=> Với 0,1 < x < 0,1 + 0,02 thì 13< M < 35 thoả mãn Na = 23 Vậy công thức sunfat là NaHSO4
Đúng 0
Bình luận (0)
Trộn 200 gam dung dịch một muối sunfat của kim loại kiềm nồng độ 13,2% với 200 gam dung dịch NaHCO3 4,2% sau phản ứng thu được m gam dung dịch A (m 400 gam). Cho 200 gam dung dịch BaCl2 20,8% vào dung dịch A sau phản ứng còn dư muối sunfat. Thêm tiếp 40 gam dung dịch BaCl2 20,8%, dung dịch thu được còn dư BaCl2. Biết các phản ứng xảy ra hoàn toàn. a) Xác định công thức muối sunfat của kim loại kiềm ban đầu. b) Tính nồng độ % của các chất tan trong dung dịch A. c) Dung dịch muối sunfat của kim l...
Đọc tiếp
Trộn 200 gam dung dịch một muối sunfat của kim loại kiềm nồng độ 13,2% với 200 gam dung dịch NaHCO3 4,2% sau phản ứng thu được m gam dung dịch A (m < 400 gam). Cho 200 gam dung dịch BaCl2 20,8% vào dung dịch A sau phản ứng còn dư muối sunfat. Thêm tiếp 40 gam dung dịch BaCl2 20,8%, dung dịch thu được còn dư BaCl2. Biết các phản ứng xảy ra hoàn toàn.
a) Xác định công thức muối sunfat của kim loại kiềm ban đầu.
b) Tính nồng độ % của các chất tan trong dung dịch A.
c) Dung dịch muối sunfat của kim loại kiềm ban đầu có thể tác dụng được với các chất nào sau đây: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Ag, Fe, CuS, Fe(NO3)2? Viết phương trình hóa học của các phản ứng xảy ra.
a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
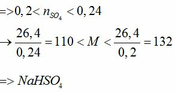
b)
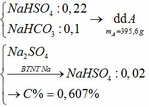
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O
Đúng 0
Bình luận (0)
Hòa tan 1,8 gam muối sunfat khan của một kim loại hóa trị II trong nước, rồi thêm nước cho đủ 50 ml dung dịch. Để phản ứng với 10 ml dung dịch này cần vừa đúng 20 ml dung dịch BaCl2 0,15M. Công thức hóa học của muối sunfat là A. CuSO4 B. FeSO4 C. MgSO4. D. ZnSO4
Đọc tiếp
Hòa tan 1,8 gam muối sunfat khan của một kim loại hóa trị II trong nước, rồi thêm nước cho đủ 50 ml dung dịch. Để phản ứng với 10 ml dung dịch này cần vừa đúng 20 ml dung dịch BaCl2 0,15M. Công thức hóa học của muối sunfat là
A. CuSO4
B. FeSO4
C. MgSO4.
D. ZnSO4
10 ml dung dịch RSO4 cần 0,15.0,02 = 0,003 mol BaCl2
⇒ 50 ml dung dịch RSO4 cần 0,015 mol BaCl2
⇒ R + 96 = 1,8/0,015 ⇒ R = 24 là Mg ⇒ Chọn C.
Đúng 0
Bình luận (0)















