Hợp chất A có công thức là MXy,trong đó M chiếm 46,67% về khối lượng.trong hạt nghân M có số p ít hơn số n là 4 hạt.tổng số p trong A là 58.Tìm A.biết X thuộc chu kì III tronh bảng tuần hoàn
Hợp chất A có công thức là MXy trong đó M chiếm 46,67% về khối lượng.trong hạt nhân M số p ít hơn số n là 4 hạt, tronh hạt nhân X có số p=e .tổng số hạt trong A là 58.xác định A ,biết X thuộc chu kì III trong bảng tuần hoàn.
các bạn ơi giúp mình với
Hợp chất H có công thức là MAx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, A là phi kim thuộc chu kì 3. Trong hạt nhân M có số hạt notron hơn số hạt proton là 4, trong hạt nhân của A có số proton và số notron bằng nhau. Tổng số proton trong là 58. Hai nguyên tố M và A là:
A. Fe và S.
B. Cr và Si
C. Cr và S
D. Fe và Si
M chiếm 46,67% về khối lượng:

Quan sát – phân tích: Hệ 5 ẩn gồm 4 phương trình không thể giải thông thường để tìm nghiện vì ta cần phải rút gọn nghiệm: Phương trình (2) chứa ẩn ZM và x. ZA từ phương trình (1); (3); (4) ta có thể đưa về 1 phương trình chứa 2 ẩn ZM và x
Z A → Đưa về hệ phương trình 2 ẩn.
Ta đưa được về hệ sau
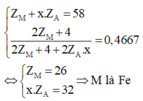
M là Fe nên x sẽ nhận giá trị từ 1 đến 3.
Từ x.ZA = 32 ta có các giá trị của ZA

Vậy H là FeS2
Đáp án A.
Một hợp chất có công thức là MAx, trong đó M chiếm 46,67% về khối lượng. M là kim loại, A là phi kim ở chu kì 3. Trong hạt nhân của M có n - p = 4, trong hạt nhân của A có n’ = p’. Tổng số proton trong MAx là 58. Xác định công thức của MAx.
A. CO2
B. CaCl2
C. SiO2
D. FeS2
Đáp án D
Trong hợp chất MAx, M chiếm 46,67% về khối lượng nên :
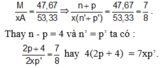
Tổng số proton trong MAx là 58 nên: p + xp’ = 58. Từ đây tìm được: p = 26 và xp’ = 32.
Do A là phi kim ở chu kì 3 nên 15 ≤ p’ ≤ 17. Vậy x = 2 và p’ = 16 thỏa mãn.
Vậy M là Fe và A là S; công thức của MAx là FeS2.
Hợp chất A có công thức MX2 trong đó M chiếm 46,67% về khối lượng. Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt. Trong hạt nhân X, số notron bằng số proton. Tổng số proton trong MX2 là 58 hạt. Công thức của MX2 là
A. FeS2
B. FeCl2
C. CuCl2
D. SO2
Tổng số proton trong MX2 là 58 hạt → ZM + 2.ZX = 58
Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt → -ZM + NM = 4
Trong hạt nhân X, số notron bằng số proton → ZX = NX
MA =ZM + NM + 2.ZX + 2.NX = (ZM + 2.ZX ) + NM + 2NX= 58 + NM + 58 - ZM = 116 + NM- ZM
M chiếm 46,67% về khối lượng → ZM + NM =
7
15
. (116 + NM- ZM ) → 22ZM + 8NM = 812
Ta có hệ
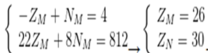
M là Fe
→ ZX =
58
-
26
2
= 16 → X là S
Công thức của A là FeS2.
Đáp án A.
Hợp chất A có công thức MX2 trong đó M chiếm 46,67% về khối lượng. Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt. Trong hạt nhân X, số notron bằng số proton. Tổng số proton trong MX2 là 58 hạt. Công thức của MX2 là
A. FeS2
B. FeCl2
C. CuCl2
D. SO2
Đáp án A
Tổng số proton trong MX2 là 58 hạt → ZM + 2.ZX = 58
Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt → -ZM + NM = 4
Trong hạt nhân X, số notron bằng số proton → ZX = NX
MA =ZM + NM + 2.ZX + 2.NX = (ZM + 2.ZX ) + NM + 2NX
= 58 + NM + 58 - ZM = 116 + NM - ZM
M chiếm 46,67% về khối lượng
![]()
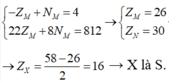
=> M là Fe
Hợp chất Y có công thức MX2 trong đó M chiếm 46,67% về khối lượng. Trong hạt nhân M có số nơtron nhiều hơn số proton là 4 hạt . Trong hạt nhân X, số nơtron bằng số proton. Tổng số proton trong MX2 là 58 hạt. Tìm AM và AX .
A. 26 và 16 B. 65 và 16 C. 56 và 32 D. 39 và 32
Hợp chất A có công thức MXx gồm kim loại M và phi kim X. Trong đó M chiếm 46,67% về khối lượng. Nguyên tử M có số p ít hơn n là 4. X là phi kim có sô p=n. Trong phân tử A có 116 hạt mang điện.
Xác định công thức phân tử hợp chất
Giả sử: M số proton và nơtron lần lượt là p và n
=> Khối lượng nguyên tử của M: mp.p+mn.n
X có số p và n lần lượt là p và n
=> Khối lượng nguyên tử của X là: mp.p +mn.n
( mp và mn lần lượt là khối lượng của 1 hạt proton và 1 hạt nơtron)
Mà mp =mn = 1,67.10^-27 nên
Khối lượng nguyên tử của M: mp.( n+p)
Khối lượng nguyên tử của X : mp.(n + p )
(+++: Vì khối lượng của 1 nguyên tử là tổng khối lượng của p, e và n, mà khối lượng của e không đáng kể nên khối lượng của nguyên tử có thể tính bằng khối lượng của p và n)
* ta có:
n-p = 4 <=> n=p+4 (1)
n =p (2)
p+ xp = 58 => xp = 58 - p (3)
* Hợp chất A có công thức MX(x) trong đó M chiếm 46,67% về khối lượng nên:
M / (M+xX) = 46,67/100 <=> [mp.(n+p)] / [mp.(n+p) + x.mp.(n +p )] = 46,67/100
<=> (n+p) / [(n+p) +x(n +p )] = 46,67/100 (4)
Thay (1), (2), (3) vào (4) ta giải ra được : p = 26 => Kim loại M chính là Fe
p=26 => n= 26 +4 = 30 và xp = 32
Với x=1 => p =32 => phi kim là Ge (loại )
Với x=2 => p =16 => phi kim là S( thuộc chu kì 3 nên thỏa mãn điều kiên=> chọn)
Vậy công thức của hợp chất A là: FeS2
Hợp chất A có công thức MXx gồm kim loại M và phi kim X. Trong đó M chiếm 46,67% về khối lượng. Nguyên tử M có số p ít hơn n là 4. X là phi kim có sô p=n. Trong phân tử A có 116 hạt mang điện.
Xác định công thức phân tử hợp chất
Hợp chất H có công thức MX2 trong đó M chiếm \(\dfrac{140}{3}\%\) về khối lượng, X là phi kim ở chu kì 3, trong hạt nhân của M có số proton ít hơn số neutron là 4 ; trong hạt nhân của X có số proton bằng số neutron.Tổng số proton trong 1 phân tử A là 58. Cấu hình electron ngoài cùng là
A.3d104s1 B.3s23p4 C.3d64s2 D.2s22p4
Có lẽ đề hỏi cấu hình e của M bạn nhỉ?
Ta có: P = E (do nguyên tử trung hòa về điện)
- M chiếm 140/3% trong MX2
\(\Rightarrow\dfrac{P_M+N_M}{P_M+N_M+2P_X+2N_X}.100\%=\dfrac{140}{3}\%\) (1)
- Trong hạt nhân của M có số p ít hơn số n là 4.
⇒ NM - PM = 4 (2)
- Trong hạt nhân của X có số p bằng số n.
⇒ NX = PX (3)
- Tổng số p trong A là 58.
⇒ PM + 2PX = 58 (4)
Từ (1), (2), (3) và (4) \(\Rightarrow\left\{{}\begin{matrix}P_M=26\\N_M=30\\P_X=16\\N_X=16\end{matrix}\right.\)
→ 1s22s22p63s23p63d64s2
→ Đáp án: C