a) Tính % oxi trong các chất sau: KMnO4, KCLO3, KNO3
b) So sánh số mol oxi điều chế được bằng sự phân huỷ số mol của mỗi chất trên
c) Phân huỷ cùng số mol của các chất trên có phải chất có hàm lượng oxi cao cho nhiều oxi
a, Tính toán để biết chất nào giàu oxi hơn: KMnO4, KClO3,KNO3
b, So sánh số mol khí Oxi điều chế được bằng sự phân hủy cùng số mol của mỗi chất nói trên
c, Có nhận xét gì về sự so sánh kết quả của câu a và b
Có thể điều chế O2 bằng cách phân huỷ KMnO4, KClO3, H2O2. Nếu lấy cùng một lượng các chất trên đem phân huỷ hoàn toàn thì thể tích oxi trong cùng điều kiện thu được
A. Từ KMnO4 là lớn nhất
B. Từ KClO3 là lớn nhất
C. Từ H2O2 là lớn nhất
D. bằng nhau
Đáp án B
PTHH:
2KMnO4 K2MnO4 + MnO2 + O2
2H2O2 → 2H2O + O2
2KClO3 → 2KCl + 3O2
Có thể điều chế O2 bằng cách phân huỷ KMnO4, KClO3, H2O2. Nếu lấy cùng một lượng các chất trên đem phân huỷ hoàn toàn thì thể tích oxi trong cùng điều kiện thu được:
A. Từ KMnO4 là lớn nhất
B. Từ KClO3 là lớn nhất
C. Từ H2O2 là lớn nhất
D. Bằng nhau
a) So sánh số mol oxi điều chế được bằng sự phân huỷ số mol của mỗi chất trên
b) Phân huỷ cùng số mol của các chất trên có phải chất có hàm lượng oxi cao cho nhiều oxi
Giúp với
Để điều chế khí oxi người ta phân hủy KMnO4 và KCLO3
a/Để thu được lượng khí oxi như nhau,chất nào cần số mol nhiều hơn?Cần dùng khối lượng nhiều hơn?
b/phân hủy cùng số mol,chất nào sinh ra khí nhiều hơn?
c/phân hủy cùng khối lượng chất nào sinh ra khí oxi nhiều hơn?
d/Biết giá thành 1kg KMnO4 là 200000đ,1kg KCLO3 là 300000đ,hãy cho biết để điều chế khí oxi như nhau,thì dùng chất nào có giá thành rẻ nhiều hơn?
a)6KMnO4--->3K2MnO4 + 3MnO2 + 3O2 (1)
2KClO3---> 2KCl + 3O2 (2)
Dựa vào phương trình trên ---> thu cùng lượng O2, KMnO4 cần nhiều số mol hơn, và khối lượng nhiều hơn.
b)6KClO3-->6KCl + 9O2 (3)
1,3--->Cùng số mol, KClO3 cho nhiều O2 hơn.
c)Giả sử cả 2 chất cùng có khối lượng là 100g
nKMnO4=50/79(mol)
nKClO3=40/49
Thay vào các phương trình phản ứng tính ra mO2
Cụ thể: KMnO4 cho ra 800/79 (g) O2
KClO3 cho ra 1920/49 (g) O2
---> Cùng m thì KClO3 cho nhiều g O2 hơn.
d) Giả sử cần điều chế 32 g O2
--->nO2=1 mol
--->nKMnO4=2 mol--->mKMnO4=316g
và nKClO3=2/3 mol--->nKClO3=245/3g
Ta có:
-1000g KMnO4 <=> 200000đ
316 g=========>63200đ
-1000g KClO3 <=> 300000đ
245/3g========> 24500đ
Vậy để điều chế cùng lượng O2, KClO3 có giá thành rẻ hơn.
Trong phòng thí nghiệm có thể dùng muối KClO3 hoặc KMnO4 để điều chế oxi bằng phản ứng phân hủy. Viết phương trình hóa học của các phản ứng và tính thể tích khí oxi thu được (đktc) khi nhiệt phân hoàn toàn 0,1 mol mỗi chất trên.
giúp mình với mn ơi thanks mn nhìu lắm yêu mn :3
Các bạn giúp mình trả lời câu hỏi này với mình cảm ơn !
a) Tính toán để biết trong các chất sau chất nào giàu oxi hơn: KMnO4 ;KClO3; KNO3
b)So sánh số mol khí oxi điều chế được bằng sự phân huỷ cùng số mol của mỗi chất nói trên.
c) Có nhận xét gì về sự so sánh kết quả của câu a và câu b
a.
\(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\left(1\right)\)
\(2KClO_3\rightarrow2KCl+3O_2\left(2\right)\)
\(KNO_3\rightarrow KNO_2+\frac{1}{2}O_2\left(3\right)\)
Giả sử KMnO4, KClO3, KNO3 đề có 1 mol
\(n_{O2\left(1\right)}=\frac{1}{2}=0,5\)
\(n_{O2\left(2\right)}=\frac{1.3}{2}=1,5\)
\(n_{O2\left(3\right)}=\frac{1}{2}=0,5\)
\(\rightarrow\) KClO3 giàu oxi nhất
Sau đó là KMnO4 và KNO3
Và KNO3 và KMnO4 giàu oxi như nhau
Có những chất sau: KMnO4, MnO2, K2Cr2O7 và dung dịch HCl.
a) Nếu các chất oxi hóa có khối lượng bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
b) Nếu chất oxi hóa có số mol bằng nhau thì chọn chất nào có thể điều chế được lượng khí clo nhiều hơn?
Hãy trả lời bằng cách tính toán trên cơ sở của các phương trình phản ứng.
a) Giả sử lấy lượng mỗi chất là a gam
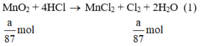
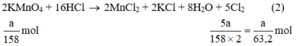
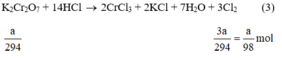
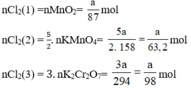
Ta có: 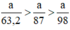
Lượng Cl2 điều chế được từ pt (2) nhiều nhất.
Vậy dùng KMnO4 điều chế được nhiều Cl2 hơn.
b) Nếu lấy số mol các chất bằng a mol
Theo (1) nCl2(1) = nMnO2 = a mol
Theo (2) nCl2(2) = 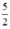 . nKMnO4 = 2,5a mol
. nKMnO4 = 2,5a mol
Theo (3) nCl2(3) = 3. nK2Cr2O7 = 3a mol
Ta có: 3a > 2,5a > a.
⇒ lượng Cl2 điều chế được từ pt (3) nhiều nhất.
Vậy dùng K2Cr2O7 được nhiều Cl2 hơn.