Đổ từ từ 200ml (KHSO4 xM, Na2SO4 0,5M) vào 200 ml (NaHCO3 yM, K2CO3 0,5M ), sau phản ứng thu được 3,36 lít khí (đktc) và dung dịch B. Đổ Ba(OH)2 dư vào B thu được 101,25 gam hỗn hợp kết tủa. Giá trị của x và y là

Những câu hỏi liên quan
Đổ từ từ 200ml (KHSO4 xM, Na2SO4 0,5M) vào 200 ml (NaHCO3 yM, K2CO3 1M ), sau phản ứng thu được 3,36 lít khí (đktc) và dung dịch B. Đổ Ba(OH)2 dư vào B thu được 134,4 gam kết tủa. Giá trị của x và y là
n KHSO4 = 0,2x(mol)
n Na2SO4 = 0,2.0,5 = 0,1(mol)
n NaHCO3 = 0,2y(mol)
n K2CO3 = 0,2(mol)
n CO2 = 3,36/22,4 = 0,15(mol)
Bảo toàn nguyên tố với S :
n BaSO4 = n KHSO4 + n Na2SO4 = 0,1 + 0,2x(mol)
Bảo toàn nguyên tố với C :
n BaCO3 + n CO2 = n NaHCO3 + n K2CO3
=> n BaCO3 = 0,2y + 0,05(mol)
Suy ra: (0,1 + 0,2x).233 + (0,2y + 0,05).197 = 134,4(1)
$CO_3^{2-} + H^+ \to HCO_3^-$
$HCO_3^- + H^+ \to CO_2 + H_2O$
Theo PTHH :
n H+ = n KHSO4 = 0,2x = n CO32- + n CO2 = 0,2 + 0,15(2)
Từ (1)(2) suy ra : x = 1,75 ;y =0,5
Đúng 3
Bình luận (0)
Đổ từ từ 200ml (KHSO4 xM, Na2SO4 yM) vào 200 ml (Ba(HCO3)2 1M, NaHCO3 1M) thu được 4,48 lít khí, m gam kết tủa và dung dịch A. Thêm Ba(OH)2 dư vào A xuất hiện thêm 125,4 gam kết tủa. Giá trị của x và y là
Đổ từ từ 100ml (KHSO4 xM, Na2SO4 0,5M) vào 200 ml (KHCO3 yM, Na2CO3 zM), sau phản ứng thu được 1,12 lít khí (đktc) và dung dịch B. Chia B thành 2 phần bằng nhau:
Phần 1: Cho phản ứng với BaCl2 dư thu được 23,3 gam kết tủa.
Phần 2: Cho phản ứng với Ba(OH)2 dư thu được 38,074 gam kết tủa.
Giá trị của x, y, z là
Đổ 200ml (NaOH xM, BaCl2 1M) vào 200 ml (NaHCO3 yM, Na2CO3 0,5M) sau phản ứng thu được 29,55 gam kết tủa và dung dịch A. Thêm HCl vào A thấy thoát ra tối đa 3,36 lít khí. Giá trị của x và y là
n NaOH = 0,2x(mol)
n BaCl2 = 0,2(mol)
n NaHCO3 = 0,2y(mol)
n Na2CO3 = 0,1(mol)
n BaCO3 = 29,55/197 = 0,15(mol)
n CO2 = 3,36/22,4 = 0,15(mol)
Bảo toàn nguyên tố với C :
0,2y + 0,1 = 0,15 + 0,15
=> y = 1
Dung dịch A gồm :
Na+ : 0,2x + 0,2y + 0,1 = 0,2x + 0,3(mol)
Ba2+ : 0,2 - 0,15 = 0,05(mol)
Cl- : 0,4(mol)
HCO3- : 0,15(mol)
Bảo toàn điện tích :
0,2x + 0,3 + 0,05.2 = 0,4 + 0,15
=> x = 0,75
Đúng 1
Bình luận (3)
Cho từ từ 156 ml dung dịch X chứa H2SO4 0,5M vào 200 ml dung dịch Y gồm K2CO3 và KHCO3 thì thu được 1,7024 lít khí (đktc). Mặt khác nếu cho 200 ml dung dịch Y vào 156 ml dung dịch X thì thu được V lít khí (đktc), cho thêm Ba(OH)2 dư vào dung dịch sau phản ứng thì thu được 32,358 gam kết tủa khan. Các phản ứng xảy ra hoàn toàn. Giá trị V gần nhất với A. 2,2 B. 2,6 C. 2,4 D. 2,8
Đọc tiếp
Cho từ từ 156 ml dung dịch X chứa H2SO4 0,5M vào 200 ml dung dịch Y gồm K2CO3 và KHCO3 thì thu được 1,7024 lít khí (đktc). Mặt khác nếu cho 200 ml dung dịch Y vào 156 ml dung dịch X thì thu được V lít khí (đktc), cho thêm Ba(OH)2 dư vào dung dịch sau phản ứng thì thu được 32,358 gam kết tủa khan. Các phản ứng xảy ra hoàn toàn. Giá trị V gần nhất với
A. 2,2
B. 2,6
C. 2,4
D. 2,8
Chọn đáp án D
nH2SO4 = 0,156x0,5 = 0,078 Þ nH+ = 0,078x2 = 0,156
Cho từ từ 0,156 H+ vào

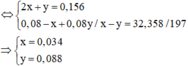
Vậy V = (0,034 + 0,088)x22,4=2,7328
Đúng 0
Bình luận (0)
Dung dịch A chứa hỗn hợp HCl 1,4M và H2SO4 0,5M. Cho V lít dung dịch hỗn hợp NaOH 2M và Ba(OH)2 4M vào 500 ml dung dịch A, thu được kết tủa B và dung dịch C. Cho thanh Zn ( lấy dư) vào dung dịch C, sau khi phản ứng kết thức thu được 3,36 lít khí H2 (đktc). Xác định giá trị V và khối lượng kết tủa B.
nHCl = 0,5.1,4 = 0,7 (mol) ; nH2SO4 = 0,5.0,5 = 0,25 (mol) => nSO42- = nH2SO4 = 0,25 (mol)
∑ nH+ = nHCl + 2nH2SO4 = 0,7 + 2.0,25 = 1,2 (mol)
nNaOH = 2V (mol) ; nBa(OH)2 = 4V (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 2V + 2.4V = 10V (mol)
Các PTHH xảy ra:
H+ + OH- → H2O (1)
Ba2+ + SO42- → BaSO4↓ (2)
Khi cho Zn vào dd C thấy có khí H2 thoát ra => có 2 trường hợp có thể xảy ra. Zn có thể bị hòa tan bởi dung dịch axit hoặc bazo
nH2 = 3,36 : 22,4 = 0,15 (mol)
TH1: dd C có chứa H+ dư => phản ứng (1) OH- phản ứng hết
Zn + 2H+ → Zn2+ + H2↑ (3)
0,3 ← 0,15 (mol)
=> nH+ (1) = ∑ nH+ - nH+ dư = 1,2 – 0,3 = 0,9 (mol)
Theo (1): ∑nOH- = nH+ (1) = 0,9 = 10V => V = 0,09 (lít)
nBa(OH)2 = 4.0,09 = 0,36 => nBa2+ = nBa(OH)2 = 0,36 (mol) > nSO42-
Từ PTHH (2) => nBaSO4 = nSO42- = 0,25 (mol) => mBaSO4 = 0,25.233 = 58,25(g)
TH2: dd C có chứa OH- dư => phản ứng (1) H+ phản ứng hết
Zn + 2OH- → ZnO22- + H2↑ (4)
0,3 ← 0,15 (mol)
=> ∑ nOH- = nOH-(1) + nOH- (4) = 1,2 + 0,3 = 1,5 (mol)
=> 10V = 1,5
=> V = 0,15 (lít)
=> nBa(OH)2 = 0,15. 4 = 0,6 (mol)
=> nBa2+ = 0,6 (mol) > nSO42- = 0,25 (mol)
=> mBaSO4 = 0,25.233 = 58,25 (g)
Đúng 0
Bình luận (0)
Hấp thụ hết 5,6 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 250 ml dung dịch X. Cho từ từ đến hết 125 ml dung dịch X vào 375 ml dung dịch HCl 0,5M, thu được 3,36 lít khí (đktc). Mặt khác, cho 125 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 49,25 gam kết tủa. Giá trị của x là A. 0,100. B. 0,125 C. 0,050. D. 0,300.
Đọc tiếp
Hấp thụ hết 5,6 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 250 ml dung dịch X. Cho từ từ đến hết 125 ml dung dịch X vào 375 ml dung dịch HCl 0,5M, thu được 3,36 lít khí (đktc). Mặt khác, cho 125 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 49,25 gam kết tủa. Giá trị của x là
A. 0,100.
B. 0,125
C. 0,050.
D. 0,300.
Đáp án B
► Xét TN1: đặt nCO32– phản ứng = a; nHCO3– phản ứng = b.
⇒ nCO2 = a + b = 0,15 mol; nHCl phản ứng = 2a + b = 0,1875 mol
||⇒ giải hệ có: a = 0,0375 mol; b = 0,1125 mol ⇒ nCO32–/X : nHCO3–/X = a : b = 1 : 3.
► Xét TN2: ∑nC/X = n↓ = 0,25 mol ⇒ 250 ml X chứa 0,5 mol C.
Bảo toàn nguyên tố Cacbon: y = 0,5 – 0,25 = 0,25 mol.
● Chia 0,5 mol C thành 0,125 mol CO32– và 0,375 mol HCO3–.
Bảo toàn điện tích: nK+ = 0,625 mol. Bảo toàn nguyên tố Kali:
x = 0,625 – 0,25 × 2 = 0,125 mol
Đúng 0
Bình luận (0)
Hấp thụ hết 5,6 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 250 ml dung dịch X. Cho từ từ đến hết 125 ml dung dịch X vào 375 ml dung dịch HCl 0,5M, thu được 3,36 lít khí (đktc). Mặt khác, cho 125 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 49,25 gam kết tủa. Giá trị của x là A. 0,100. B. 0,125. C. 0,050. D. 0,300.
Đọc tiếp
Hấp thụ hết 5,6 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 250 ml dung dịch X. Cho từ từ đến hết 125 ml dung dịch X vào 375 ml dung dịch HCl 0,5M, thu được 3,36 lít khí (đktc). Mặt khác, cho 125 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 49,25 gam kết tủa. Giá trị của x là
A. 0,100.
B. 0,125.
C. 0,050.
D. 0,300.
Đáp án B
► Xét TN1: đặt nCO32– phản ứng = a; nHCO3– phản ứng = b.
⇒ nCO2 = a + b = 0,15 mol; nHCl phản ứng = 2a + b = 0,1875 mol
||⇒ giải hệ có: a = 0,0375 mol; b = 0,1125 mol ⇒ nCO32–/X : nHCO3–/X = a : b = 1 : 3.
► Xét TN2: ∑nC/X = n↓ = 0,25 mol ⇒ 250 ml X chứa 0,5 mol C.
Bảo toàn nguyên tố Cacbon: y = 0,5 – 0,25 = 0,25 mol.
● Chia 0,5 mol C thành 0,125 mol CO32– và 0,375 mol HCO3–.
Bảo toàn điện tích: nK+ = 0,625 mol. Bảo toàn nguyên tố Kali:
x = 0,625 – 0,25 × 2 = 0,125 mol
Đúng 0
Bình luận (0)
Hấp thụ hết 5,6 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 250 ml dung dịch X. Cho từ từ đến hết 125 ml dung dịch X vào 375 ml dung dịch HCl 0,5M, thu được 3,36 lít khí (đktc). Mặt khác, cho 125 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 49,25 gam kết tủa. Giá trị của x là A. 0,125 B. 0,175 C. 0,375 D. 0,300
Đọc tiếp
Hấp thụ hết 5,6 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3, thu được 250 ml dung dịch X. Cho từ từ đến hết 125 ml dung dịch X vào 375 ml dung dịch HCl 0,5M, thu được 3,36 lít khí (đktc). Mặt khác, cho 125 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, thu được 49,25 gam kết tủa. Giá trị của x là
A. 0,125
B. 0,175
C. 0,375
D. 0,300







