Lập công thức của hợp chất được tạo bởi 2 nguyên tố là S và O với tỉ lệ khối lượng hai nguyên tố lần lượt là 2:3 . Biết tỉ khối so của hợp chất so với không khí là 2,75862
Gọi CTHH của hợp chất là: `S_xO_y` `(x,y>0)`
`d_(\frac{M_(hc)}{29}=2,75862`
`=>M_(hc)=80`
`=> 32x+16y=80`
mà `32x:16y=2:3`
`=>{(x=1),(y=3):}`
`=>CTHH:SO_3`
Đúng 3
Bình luận (0)

Câu 3. (4 đ) Khi cho 3,7185 lít (đk 1 bar, 25 độ C) hỗn hợp khí gồm CH4, C2H2 vào dung dịch AgNO3/NH3 thấy có 28,8 gam kết tủa vàng nhạt. Vậy nếu khi đốt cháy hỗn hợp trên thì thể tích khí CO2 (đk: 25 độ C, áp suất 1 Bar) và khối lượng nước tạo thành là bao nhiêu?
Câu 3 :
\(CH_4+\left[\left(AgNH_3\right)_2\right]OH\underrightarrow{ko.xảy.ra}\)
\(CH\equiv CH+2\left[Ag\left(NH_3\right)_2\right]OH\rightarrow AgC\equiv CAg\downarrow+4NH_3+2H_2O\)
0,12 0,24
\(n_{C_2Ag_2}=\dfrac{28,8}{240}=0,12\left(mol\right)\)
\(C_2Ag_2+\dfrac{5}{2}O_2\underrightarrow{t^0}2CO_2+Ag_2O\)
0,12 0,24
\(\Rightarrow V_{CO_2}=0,24.24,79=5,9496\left(l\right)\)
\(\Rightarrow m_{H_2O}=0,24.18=4,32\left(g\right)\)
Đúng 0
Bình luận (0)
Cho 100 mL dung dịch CH3COOH 2M tác dụng hết với Zn.a) Tính thể tích khí thoát ra ở đkc.b) Tính khối lượng Zn phản ứng.c) Tính nồng độ mol dung dịch thu được sau phản ứng (giả sử thể tích dung dịch thay đổi không đáng kể).
Đọc tiếp
Cho 100 mL dung dịch CH3COOH 2M tác dụng hết với Zn.
a) Tính thể tích khí thoát ra ở đkc.
b) Tính khối lượng Zn phản ứng.
c) Tính nồng độ mol dung dịch thu được sau phản ứng (giả sử thể tích dung dịch thay đổi không đáng kể).
a,`n_(CH_3COOH)=C_M*V=2*0,1=0,2(mol)`
PTHH: `2CH_3COOH+Zn->(CH_3COO)_2Zn + H_2 \uparrow`
Số mol của `H_2` thoát ra là: `n_(H_2)=\frac{n_(CH_3COOH)}{2}=\frac{0,2}{2}=0,1(mol)`
Thể tích khí thoát ra ở đkc: `V=n*22,4=0,1*22,4=2,24(l)`
b, Số mol `Zn` phản ứng: `n_(Zn)=frac{n_(CH_3COOH)}{2}=\frac{0,2}{2}=0,1(mol)`
Khối lượng `Zn` phản ứng: `m=n*M=0,1*65=6,5(g)`
c, Số mol của `(CH_3COO)_2Zn` là: `n=frac{n_(CH_3COOH)}{2}=\frac{0,2}{2}=0,1(mol)`
Nồng độ mol của dung dịch thu được sau phản ứng là: `C_M=n/V=\frac{0,1}{0,1}=1M`
Đúng 1
Bình luận (0)
một hợp chất oxide là một kim loại R có dạng RxOy (chưa biết hóa trị), phần trăm khối lượng của R trong hợp chất là 72,414% xác định công thức oxide trên
Ta tìm được phần trăm khối lượng oxi là 27,586%
=> M = 58
Ta có: y = 58.27,586/16 = 1
=> khối lượng R = 58-16=42
Tìm được y = 58x72,414/42=1
=> công thức RO ?
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 7,4g hỗn hợp CH4 , C4H10 thu được 11,2(L) , CO2 (đktc)
a) tính phần trăm khối lượng của mỗi Alkane ?
b) Tính khối lượng nước tạo thành ?
a, Gọi số mol của `CH_4, C4H10` lần lượt là: `x,y(mol)` `(a,b>0)`
`=> m= m_(CH_4) + m_(C_4H_10)= 16x + 58y=7,4(g)`
Số mol của khí `CO_2` thu được là: `n_(CO_2)=V/22,4=11,2/22,4=0,5(mol)`
PTHH: `CH_4 + 2O_2 -> CO_2 + 2H_2O`
`x` `x` `2x`
`C_4H_10 + \frac{13}{2} O_2 -> 4CO_2 + 5H_2O`
`y` `4y` `5y`
Ta có hệ phương trình: `{(x+4y=0,5),(16a+58b=7,4):}`
`=>{(x=0,1),(y=0,1):}`
Thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp:
`%m_(CH_4) = \frac{m_(CH_4)}{m_(hh)} *100 = \frac{16*0,1}{7,4} *100= 21,62%`
`%m_(C_4H_10)=100%-21,62%=78,38%`
b, Số mol của nước tạo thành: `n_(H_2O)= 2x+5y =2.0,1+5.0,1=0,7(mol)`
Khối lượng nước tạo thành: `m_(H_2O)= M*n= 18*0,7=12,6(g)`
Đúng 1
Bình luận (0)
Cho 34,8 g một Fe xOy tác dụng vừa đủ với 800 ml dung dịch HCl nồng độ 1,5 M xác định công thức hóa học của FexOy
Giups m vs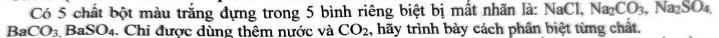
Có 5 chất bột màu trắng đựng trong 5 bình riêng biệt bị mất nhãn là: NaCl, Na₂CO₃, Na₂SO₄, BaCO₃, BaSO₄. Chỉ được dùng thêm nước và CO₂, hãy trình bày cách phân biệt từng chất.
 giúp m vs
giúp m vs
Cho 6 lọ chứa các dung dịch (riêng biệt) bị mất nhãn: NaCl, AlCl₃, K₂SO₄, NH₄NO₃, HCl, Ba(OH)₂. Chỉ dùng thêm dung dịch phenolphtalein làm thuốc thử, hãy nhận biết các dung dịch trên. Viết các phương trình phản ứng hóa học minh họa.
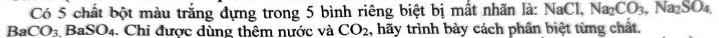 giúp m vs
giúp m vs
Có 5 chất bột màu trắng đựng trong 5 bình riêng biệt bị mất nhãn là: NaCl, Na₂CO₃, Na₂SO₄, BaCO₃, BaSO₄. Chỉ được dùng thêm nước và CO₂, hãy trình bày cách phân biệt từng chất.
Trích mẫu thử và đánh số các mẫu
Cho từng mẫu dung dịch tác dụng lần lượt với nhau
- Dung dịch tạo ra 2 kết tủa trắng là `BaCl_2`
PTHH: `BaCl_2 + (NH_4)_2SO_4 -> BaSO_4 \downarrow + 2NH_4Cl`
`BaCl_2 + H_2SO_4 -> BaSO_4 \downarrow + 2HCl`
- Dung dịch tạo ra 1 kết tủa trắng là `H_2SO_4`
PTHH: `BaCl_2 + H_2SO_4 -> BaSO_4 \downarrow + 2HCl`
- Dung dịch tạo ra 1 kết tủa keo trắng là `AlCl_3`
PTHH: `AlCl_3 + 3NaOH -> Al(OH)_3 \downarrow + 3NaCl`
- Dung dịch tạo ra 1 kết tủa trắng, 1 khí không màu là `(NH_4)_2SO_4`
PTHH: `BaCl_2 + (NH_4)_2SO_4 -> BaSO_4 \downarrow + 2NH_4Cl`
`2NaOH + (NH_4)_2SO_4 -> Na_2SO_4 + 2NH_3 \uparrow + 2H_2O`
- Dung dịch tạo ra 1 kết tủa keo trắng, 1 khí không màu là `NaOH`
PTHH: `AlCl_3 + 3NaOH -> Al(OH)_3 \downarrow + 3NaCl`
`2NaOH + (NH_4)_2SO_4 -> Na_2SO_4 + 2NH_3 \uparrow + 2H_2O`
Đúng 1
Bình luận (0)
cách biểu diễn 3 nguyên tử cacbon là j vấy mn














