Viết pt khi: a, dẫn khí so3 vào dd h2so4 đặc b, cho sắt vào hno3 loãng nóng

Những câu hỏi liên quan
Hòa tan hoàn toàn a gam sắt vào dung dịch H2SO4 loãng thu được 4,48 lít khí. Mặt khác cũng hòa tan hết a gam sắt vào H2SO4 đặc nóng dư được V lít khí. Cho khí này phản ứng với dung dịch KMnO4 2M vừa đủ. Viết các phương trình phản ứng, tính V và V dd KMnO4 2M
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (1)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\) (2)
\(5SO_2+2KMnO_4+2H_2O\rightarrow2MnSO_4+K_2SO_4+2H_2SO_4\) (3)
Ta có: \(n_{H_2}=0,2\left(mol\right)\)
Theo PT (1): \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
Theo PT (2): \(n_{SO_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,3.22,4=6,72\left(l\right)\)
Theo PT (3): \(n_{KMnO_4}=\dfrac{2}{5}n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow V_{KMnO_4}=\dfrac{0,12}{2}=0,06\left(l\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Hòa tan hoàn toàn a gam sắt vào axit HCl thu được 3,36 lít khí. Hòa tan hết cũng a gam sắt vào axit H2SO4 đặc, nóng, dư thu được x lít khí. Còn khi hòa tan hết a gam sắt vào HNO3 loãng, dư thu được y lít khí NO. Tính x, y đo ở cùng điều kiện
Giả sử có u (mol) Fe
TN1:
PTHH: Fe + 2HCl --> FeCl2 + H2
u--------------------->u
=> \(n_{H_2}=u\left(mol\right)\)
TN2:
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
u------------------------------>1,5u
=> \(n_{SO_2}=1,5u\left(mol\right)\)
Có: \(\dfrac{V_{SO_2}}{V_{H_2}}=\dfrac{n_{SO_2}}{n_{H_2}}=\dfrac{1,5u}{u}=1,5\Rightarrow V_{SO_2}=1,5.3,36=5,04\left(l\right)\)
TN3:
PTHH: Fe + 4HNO3 --> Fe(NO3)3 + NO + 2H2O
u-------------------------->u
=> \(n_{NO}=u\left(mol\right)\)
Có: \(\dfrac{V_{NO}}{V_{H_2}}=\dfrac{n_{NO}}{n_{H_2}}=\dfrac{u}{u}=1\Rightarrow V_{NO}=3,36\left(l\right)\)
Đúng 4
Bình luận (0)
cho 11,8 g hh X gồm cu và fe vào dd h2so4 loãng dư đến khi pu xảy ra hoàn toàn thì thu được 0,56(l) khí ở kdtc).Cũng lượng X trên cho vào dd h2so4 đặc nóng thì thu được V lít khí so2(dktc),dẫn lượng khí thu được vào 250ml dd naoh 1M,thu được 21,9g muối
a)tính thành phần % khối lượng mỗi kl trong hh ban đầu
b)Tính V
\(n_{H_2}=\dfrac{0,56}{22,4}=0,025\left(mol\right)\)
\(n_{NaOH}=0,25.1=0,25\left(mol\right)\)
Cho X vào dung dịch `H_2SO_4` loãng:
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,025<-----------------------0,025
a. \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{56.0,025.100\%}{11,8}=11,86\%\\\%m_{Cu}=\dfrac{\left(11,8-0,025.56\right).100\%}{11,8}=88,14\%\end{matrix}\right.\)
b. \(n_{Cu}=\dfrac{11,8-0,025.56}{64}=0,1625\left(mol\right)\)
Cũng lượng X trên cho vào dung dịch `H_2SO_4` đặc nóng:
Giả sử Fe tác dụng hết với dung dịch \(H_2SO_{4.đn}\)
\(2Fe+6H_2SO_{4.đn}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,025----------------------------------->0,0375
\(Cu+2H_2SO_{4.đn}\rightarrow CuSO_4+SO_2+2H_2O\)
0,1625--------------------------->0,1625
\(\Sigma n_{SO_2}=0,0375+0,1625=0,2\left(mol\right)\)
Có: \(\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0,25}{0,2}=1,25\)
=> Phản ứng giữa `NaOH` và `SO_2` tạo muối axit trước (tỉ lệ 1:1)
\(SO_2+NaOH\rightarrow NaHSO_3\)
0,2---->0,2------->0,2
Xét \(\dfrac{0,2}{1}< \dfrac{0,25}{1}\Rightarrow\) NaOH dư.
\(n_{NaOH.dư}=0,25-0,2=0,05\left(mol\right)\)
\(NaOH+NaHSO_3\rightarrow Na_2SO_3+H_2O\)
0,05----->0,05---------->0,05
Xét \(\dfrac{0,05}{1}< \dfrac{0,2}{1}\Rightarrow NaHSO_3.dư\)
Sau phản ứng thu được: \(\left\{{}\begin{matrix}n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\\n_{Na_2SO_3}=0,05\left(mol\right)\end{matrix}\right.\)
\(m_{muối}=0,15.104+0,05.126=21,9=m_{muối.thu.được.theo.đề}\)
=> Giả sử đúng.
\(\Rightarrow V=V_{SO_2}=0,2.22,4=4,48\left(l\right)\)
Đúng 1
Bình luận (0)
Thực hiện các thí nghiệm sau: (a) Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp). (b) Cho FeO vào dung dịch HNO3 loãng, dư, đun nóng. (c) Cho Si vào dung dịch NaOH dư. (d) Cho dnug dịch NaHSO4 vào dung dịch NaHCO3. (e) Cho dung dịch Fe(NO3)2 vào dung dịch H2SO4 loãng. (g) Cho đinh sắt vào dung dịch H2SO4 đặc, nóng (dư). Sau khi các phản ứng xảy ra, số thí nghiệm sinh ra chất khí là A. 4 B. 6 C. 5. D. 2.
Đọc tiếp
Thực hiện các thí nghiệm sau:
(a) Điện phân dung dịch NaCl (điện cực trơ, màng ngăn xốp).
(b) Cho FeO vào dung dịch HNO3 loãng, dư, đun nóng.
(c) Cho Si vào dung dịch NaOH dư.
(d) Cho dnug dịch NaHSO4 vào dung dịch NaHCO3.
(e) Cho dung dịch Fe(NO3)2 vào dung dịch H2SO4 loãng.
(g) Cho đinh sắt vào dung dịch H2SO4 đặc, nóng (dư).
Sau khi các phản ứng xảy ra, số thí nghiệm sinh ra chất khí là
A. 4
B. 6
C. 5.
D. 2.
Chọn B.
(a) 2NaCl + 2H2O → d p d d 2NaOH + H2 + Cl2
(b) FeO + HNO3 ® Fe(NO3)3 + NO + H2O
(c) Si + NaOH + H2O ® Na2SiO3 + H2
(d) NaHSO4 + NaHCO3 ® Na2SO4 + CO2 + H2O
(e) 3Fe2+ + 4H+ + NO3- ® 3Fe3+ + NO + 2H2O
(g) 2Fe + 6H2SO4 đặc, nóng ® Fe2(SO4)3 + 3SO2 + 6H2O
Đúng 0
Bình luận (0)
Tiến hành các thí nghiệm sau: (a) Nhúng thanh Fe vào dung dịch CuSO4. (b) Dẫn khí co qua Fe2O3 nung nóng. (c) Điện phân dung dịch NaCl bão hòa, có màng ngăn. (d) Đốt bột Fe trong khí oxi. (e) Cho kim loại Ag vào dung dịch HNO3 loãng. (f) Nung nóng Cu(NO3)2. (g) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng. (h) Nung quặng xiđerit với bột sắt trong bình kín. Số thí nghiệm có xảy ra sự oxi hóa kim loại là: A. 2 B. 3 C. 5 D. 4
Đọc tiếp
Tiến hành các thí nghiệm sau:
(a) Nhúng thanh Fe vào dung dịch CuSO4.
(b) Dẫn khí co qua Fe2O3 nung nóng.
(c) Điện phân dung dịch NaCl bão hòa, có màng ngăn.
(d) Đốt bột Fe trong khí oxi.
(e) Cho kim loại Ag vào dung dịch HNO3 loãng.
(f) Nung nóng Cu(NO3)2.
(g) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng.
(h) Nung quặng xiđerit với bột sắt trong bình kín. Số thí nghiệm có xảy ra sự oxi hóa kim loại là:
A. 2
B. 3
C. 5
D. 4
Chọn đáp án B.
F e + C u S O 4 → F e S O 4 + C u ( i ) 3 C O + F e 2 O 3 → t o 3 C O 2 + 2 F e ( j ) 2 N a C l + 2 H 2 O → c ó m à n g n g ă n đ i ệ n p h â n 2 N a O H + C l 2 + H 2 ( k ) 3 F e + 3 O 2 → t o 2 F e 2 O 3 ( l ) 3 A g + 4 H N O 3 → 3 A g N O 3 + N O + 2 H 2 O ( m ) 2 C u ( N O 3 ) 2 → t o 2 C u O + 4 N O 2 + O 2 ( n ) 2 F e 3 O 4 + 10 H 2 S O 4 → t o 3 F e 2 ( S O 4 ) 3 + S O 2 + 10 H 2 O ( o ) F e C O 3 → t o F e O + C O 2
Các thí nghiệm xảy ra sự oxi hóa kim loại: (a), (d), (e).
Đúng 0
Bình luận (0)
Tiến hành các thí nghiệm sau: (a) Nhúng thanh Fe vào dung dịch CuSO4. (b) Dẫn khí co qua Fe2O3 nung nóng. (c) Điện phân dung dịch NaCl bão hòa, có màng ngăn. (d) Đốt bột Fe trong khí oxi. (e) Cho kim loại Ag vào dung dịch HNO3 loãng. (f) Nung nóng Cu(NO3)2. (g) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng. (h) Nung quặng xiđerit với bột sắt trong bình kín. Số thí nghiệm có xảy ra sự oxi hóa kim loại là: A. 2 B. 3 C. 5 D. 4
Đọc tiếp
Tiến hành các thí nghiệm sau:
(a) Nhúng thanh Fe vào dung dịch CuSO4.
(b) Dẫn khí co qua Fe2O3 nung nóng.
(c) Điện phân dung dịch NaCl bão hòa, có màng ngăn.
(d) Đốt bột Fe trong khí oxi.
(e) Cho kim loại Ag vào dung dịch HNO3 loãng.
(f) Nung nóng Cu(NO3)2.
(g) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng.
(h) Nung quặng xiđerit với bột sắt trong bình kín. Số thí nghiệm có xảy ra sự oxi hóa kim loại là:
A. 2
B. 3
C. 5
D. 4
Đáp án B
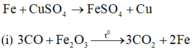
(j) 2NaCl + 2 H 2 O → c ó m à n g n g ă n đ i ệ n p h â n 2NaOH + C l 2 + H 2
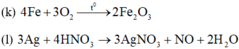
![]()
(n) 2 F e 3 O 4 + 10 H 2 S O 4 → 3 F e 2 ( S O 4 ) 3 + S O 2 + 10 H 2 O
![]()
Các thí nghiệm xảy ra sự oxi hóa kim loại: (a), (d), (e).
Đúng 0
Bình luận (0)
Tiến hành các thí nghiệm sau: (a) Nhúng thanh Fe vào dung dịch CuSO4. (b) Dẫn khí co qua Fe2O3 nung nóng. (c) Điện phân dung dịch NaCl bão hòa, có màng ngăn. (d) Đốt bột Fe trong khí oxi. (e) Cho kim loại Ag vào dung dịch HNO3 loãng. (f) Nung nóng Cu(NO3)2. (g) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng. (h) Nung quặng xiđerit với bột sắt trong bình kín. Số thí nghiệm có xảy ra sự oxi hóa kim loại là: A. 2 B. 3 C. 5 D. 4
Đọc tiếp
Tiến hành các thí nghiệm sau:
(a) Nhúng thanh Fe vào dung dịch CuSO4.
(b) Dẫn khí co qua Fe2O3 nung nóng.
(c) Điện phân dung dịch NaCl bão hòa, có màng ngăn.
(d) Đốt bột Fe trong khí oxi.
(e) Cho kim loại Ag vào dung dịch HNO3 loãng.
(f) Nung nóng Cu(NO3)2.
(g) Cho Fe3O4 vào dung dịch H2SO4 đặc, nóng.
(h) Nung quặng xiđerit với bột sắt trong bình kín. Số thí nghiệm có xảy ra sự oxi hóa kim loại là:
A. 2
B. 3
C. 5
D. 4
Chọn đáp án B
![]()
(i) ![]()
(j) 2 N a C l + 2 H 2 O → đ i ệ n p h â n 2 N a O H + C l 2 + H 2
(k) ![]()
(l) ![]()
(m) ![]()
(n) ![]()
(o) ![]()
Các thí nghiệm xảy ra sự oxi hóa kim loại: (a), (d), (e).
Đúng 0
Bình luận (0)
Thực hiện các thí nghiệm sau: (a) Nung NH4NO3 rắn. (b) Đun nóng NaCl tinh thể với dd H2SO4 (đặc). (c) Sục khí Cl2 vào dd NaHCO3. (d) Sục khí CO2 vào dd Ca(OH)2 (dư). (e) Sục khí CO2 vào dd KMnO4. (g) Cho dd KHSO4 vào dd NaHCO3. (h) Cho PbS vào dd HCl (loãng). (i) Cho Na2SO3 vào dd H2SO4 (dư), đun nóng. Số thí nghiệm sinh ra chất khí là A. 5 B. 6 C. 4 D. 2
Đọc tiếp
Thực hiện các thí nghiệm sau:
(a) Nung NH4NO3 rắn.
(b) Đun nóng NaCl tinh thể với dd H2SO4 (đặc).
(c) Sục khí Cl2 vào dd NaHCO3.
(d) Sục khí CO2 vào dd Ca(OH)2 (dư).
(e) Sục khí CO2 vào dd KMnO4.
(g) Cho dd KHSO4 vào dd NaHCO3.
(h) Cho PbS vào dd HCl (loãng).
(i) Cho Na2SO3 vào dd H2SO4 (dư), đun nóng.
Số thí nghiệm sinh ra chất khí là
A. 5
B. 6
C. 4
D. 2
Đáp án A
a. nung NH4NO3
NH4NO3 => N2O + 2H2O
b. đun nóng nacl tinh thể với dd H2SO4đặc
2NaCl +H2SO4 => Na2SO4 + 2HCl
c.sục khí Cl2 vào dd NaHCO3
Cl2 + 2NaHCO3 => 2NaCl + 2CO2 + 1/2O2 + H2O
d. sục khí co2 vào dd Ca(OH)2 dư
CO2 + Ca(OH)2 => CaCO3 + H2O
e. sục SO2 vào dd KMnO4
5 SO2 + 2 KMnO4 + 2 H2O => K2SO4 + 2 MnSO4 + 2 H2SO4
g. cho dd KHSO4 vào dd NaHCO3
KHSO4 + NaHCO3 => K2SO4 + Na2SO4 + CO2 + H2O
h. cho PbS vào dd HCl loãng : không phản ứng.
i. cho Na2SO3 vào dung dịch H2SO4 dư đun nóng
Na2SO3 + H2SO4 => Na2SO4 + H2O + SO2
Đúng 0
Bình luận (0)
Thực hiện các thí nghiệm sau: (a) Nung NH4NO3 rắn. (b) Đun nóng NaCl tinh thể với dd H2SO4 (đặc). (c) Sục khí Cl2 vào dd NaHCO3. (d) Sục khí CO2 vào dd Ca(OH)2 (dư). (e) Sục khí CO2 vào dd KMnO4. (g) Cho dd KHSO4 vào dd NaHCO3. (h) Cho PbS vào dd HCl (loãng). (i) Cho Na2SO3 vào dd H2SO4 (dư), đun nóng. Số thí nghiệm sinh ra chất khí là A. 5. B. 6. C. 4. D. 2.
Đọc tiếp
Thực hiện các thí nghiệm sau:
(a) Nung NH4NO3 rắn.
(b) Đun nóng NaCl tinh thể với dd H2SO4 (đặc).
(c) Sục khí Cl2 vào dd NaHCO3.
(d) Sục khí CO2 vào dd Ca(OH)2 (dư).
(e) Sục khí CO2 vào dd KMnO4.
(g) Cho dd KHSO4 vào dd NaHCO3.
(h) Cho PbS vào dd HCl (loãng).
(i) Cho Na2SO3 vào dd H2SO4 (dư), đun nóng.
Số thí nghiệm sinh ra chất khí là
A. 5.
B. 6.
C. 4.
D. 2.
Đáp án A
a. nung NH4NO3
NH4NO3 => N2O + 2H2O
b. đun nóng nacl tinh thể với dd H2SO4đặc
2NaCl +H2SO4 => Na2SO4 + 2HCl
c.sục khí Cl2 vào dd NaHCO3
Cl2 + 2NaHCO3 => 2NaCl + 2CO2 + 1/2O2 + H2O
d. sục khí co2 vào dd Ca(OH)2 dư
CO2 + Ca(OH)2 => CaCO3 + H2O
e. sục SO2 vào dd KMnO4
5 SO2 + 2 KMnO4 + 2 H2O => K2SO4 + 2 MnSO4 + 2 H2SO4
g. cho dd KHSO4 vào dd NaHCO3
KHSO4 + NaHCO3 => K2SO4 + Na2SO4 + CO2 + H2O
h. cho PbS vào dd HCl loãng : không phản ứng.
i. cho Na2SO3 vào dung dịch H2SO4 dư đun nóng
Na2SO3 + H2SO4 => Na2SO4 + H2O + SO2
Đúng 0
Bình luận (0)
cho 17,2 gam rắn A gồm Fe và 1 oxit sắt có tỉ lệ số mol là 2:1 vào dd H2SO4 loãng dư thu được Vml khí. Nhưng cũng lượng rắn trên nhưng cho vào dd H2SO4 đặc nóng thu được 2,24 lít khí SO2 đkc.
a) tính % khối lượng Fe có trong hỗn hợp đầu.
b) xác định oxit sắt.













