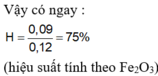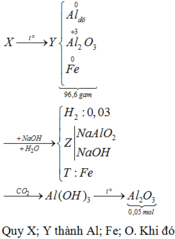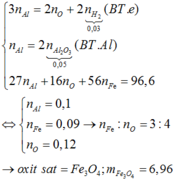Câu 7:
1. Khử 34,8g Fe3O4 bằng khí H2 dư. Tính khối lượng chất rắn thu được sau phản ứng biết hiệu suất của phản ứng đạt 90%.
2. Nung 20g hỗn hợp Al, Mg, Zn trong không khí dư. Sau khi phản ứng kết thúc thu được 29,6g hỗn hợp chất rắn A. Cho A tác dụng với lượng dư H2SO4.
a. Viết PTHH xảy ra
b. Tính khối lượng muối sunfat thu được sau phản ứng
c. Nếu cho toàn bộ kim loại trên tác dụng với dung dịch HCl dư hãy tính thể tích khí H2 thu được ở đktc