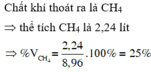Những câu hỏi liên quan
Cho 4,48 lít khí gồm metan và etilen đi qua dung dịch brom dư, thấy dung dịch nhạt màu và còn 1,12 lít khí thoát ra. Các thể tích khí đo ở điều kiện tiêu chuẩn. Thành phần phần trăm thể tích của khí metan trong hỗn hợp là:
A. 25% ; B. 50% ; C. 60% ; D. 37,5%
Hãy chọn đáp án đúng
- Đáp án A
- Khi cho hỗn hợp khí (gồm CH4 và C2H4 ) đi qua dung dịch brom thì C2H4 sẽ phản ứng hết với dung dịch brom, CH4 không tác dụng sẽ đi ra khỏi bình.
Đúng 0
Bình luận (0)
Cho 0,448 lít hỗn hợp khí gồm metan và etilen đi qua dung dịch brom dư, thấy dung dịch nhạt màu và còn 0,112 lít khí thoát ra. Biết các thể tích khí đo ở đktc, thành phần % thể tích khí metan có trong hỗn hợp là
A. 25%
B. 50%.
C. 60%.
D. 37,5%.
- Do dung dịch brom dư, nên khí thoát ra là metan.
![]()
- Chọn đáp án A.
Đúng 0
Bình luận (0)
Cho 4,48 lít hỗn hợp khí gồm CH4 và C2H2 qua dung dịch Br2 dư thấy dung dịch nhạt màu và có 2,24 lít khí thoát ra (các khí đo ở đktc). Thành phần % thể tích của CH4 trong hỗn hợp là A. 25% B. 50% C. 60% D. 37,5%
Đọc tiếp
Cho 4,48 lít hỗn hợp khí gồm CH4 và C2H2 qua dung dịch Br2 dư thấy dung dịch nhạt màu và có 2,24 lít khí thoát ra (các khí đo ở đktc). Thành phần % thể tích của CH4 trong hỗn hợp là
A. 25%
B. 50%
C. 60%
D. 37,5%
Đáp án B
0,2 mol hh khí gồm CH4 và C2H2 qua dd brom dư thấy nhạt màu và có 0,1 mol khí thoát ra.
• Khí thoát ra là CH4 → nCH4 = 0,1 mol
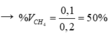
Đúng 0
Bình luận (0)
Dẫn 8,96 lít hỗn hợp khí X gồm metan và etilen vào dung dịch brom dư, thấy dung dịch nhạt màu và còn lại 2,24 lít khí thoát ra. (Thể tích các khí đều đo ở đktc). Thành phần phần trăm thể tích của metan trong X là A. 25,0% B. 50,0% C. 60,0% D. 37,5%
Đọc tiếp
Dẫn 8,96 lít hỗn hợp khí X gồm metan và etilen vào dung dịch brom dư, thấy dung dịch nhạt màu và còn lại 2,24 lít khí thoát ra. (Thể tích các khí đều đo ở đktc). Thành phần phần trăm thể tích của metan trong X là
A. 25,0%
B. 50,0%
C. 60,0%
D. 37,5%
Dẫn từ từ 5,6 lít hỗn hợp gồm metan và etilen đi qua bình đựng dd Brom dư, thấy có 1,12 lít một chất khí thoát ra khỏi bình.
a) Viết PTPƯ, cho biết tên chất khí thoát ra khỏi bình.
b) Tính % thể tích từng chất khí trong hỗn hợp.
c) Tính khối lượng dd Brom đã tham gia phản ứng. Biết các khí đều đo ở đktc.
a, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Khí thoát ra khỏi bình là CH4 (metan).
b, Ta có: \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{1,12}{5,6}.100\%=20\%\\\%V_{C_2H_4}=100-20=80\%\end{matrix}\right.\)
c, Ta có: \(V_{C_2H_4}=5,6.80\%=4,48\left(l\right)\)
\(\Rightarrow n_{C_2H_4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo PT: \(n_{Br_2}=n_{C_2H_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{Br_2}=0,2.160=32\left(g\right)\)
Bạn tham khảo nhé!
Đúng 2
Bình luận (0)
Dẫn 8,96 lít hỗn hợp khí X gồm metan và etilen vào dung dịch brom dư, thấy dung dịch nhạt màu và còn lại 2,24 lít khí thoát ra. (Thể tích các khí đều do(đktc)). Thành phần phần trăm thể tích của metan trong X là
A. 25,0%
B. 50,0%
C. 60,0%
D. 37,5%
Đáp án A
Hướng dẫn
Chất khí thoát ra là CH4 => thể tích CH4 là 2,24 lít
=> % V C H 4 = 2 , 24 8 , 96 .100% = 25%
Đúng 0
Bình luận (0)
Hỗn hợp X gồm metan và Anken A , cho 5,6 lít hỗn hợp X lội qua dd brom dư thấy khối lượng bình brom tăng thêm 3,64g và có 2,688 lít khí thoát ra ( đktc). Tên thông thường có của Anken A là?
Xem chi tiết
Khí thoát ra là metan.
CTHH của A :CnH2n
Suy ra:
\(n_A = \dfrac{5,6-2,688}{22,4} = 0,13(mol)\\ m_A =m_{tăng} = 3,64(gam)\)
Suy ra: 0,13.14n = 3,64 ⇒ n = 2
Vậy A là \(C_2H_2\)(Axetilen)
Đúng 3
Bình luận (0)
Bài 5. Hỗn hợp B gồm 2 khí metan và etilen. Dẫn 4,48 lít B (đktc) vào dung dịch brom thấy bình brom nhạt màu và có 3,36 lít khí thoát ra.(1) Tính % về thể tích của mỗi khí trong hỗn hợp ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………(2) Đốt cháy hoàn toàn 3,36 lít khí thoát ra rồi dẫn sản phẩm vào dung dịch Ca(OH)2 dư. Tính khối lượng kết tủa thu được? ………………………………...
Đọc tiếp
Bài 5. Hỗn hợp B gồm 2 khí metan và etilen. Dẫn 4,48 lít B (đktc) vào dung dịch brom thấy bình brom nhạt màu và có 3,36 lít khí thoát ra.
(1) Tính % về thể tích của mỗi khí trong hỗn hợp
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
(2) Đốt cháy hoàn toàn 3,36 lít khí thoát ra rồi dẫn sản phẩm vào dung dịch Ca(OH)2 dư. Tính khối lượng kết tủa thu được?
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
………………………………………………………………………………………………
B5:
1)
\(V_{thoát}=V_{CH_4\left(đktc\right)}=3,36\left(l\right)\\ \Rightarrow\%V_{\dfrac{CH_4}{B}}=\dfrac{3,36}{4,48}.100=75\%\Rightarrow\%V_{\dfrac{C_2H_4}{B}}=100\%-75\%=25\%\)
2)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\\ n_{CH_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ \Rightarrow n_{CaCO_3}=n_{CO_2}=n_{CH_4}=0,15\left(mol\right)\\ \Rightarrow m_{\downarrow}=m_{CaCO_3}=100.0,15=15\left(g\right)\)
Đúng 3
Bình luận (0)
Dẫn 3,36 lít hỗn hợp khí A gồm CH4 và C2H2 qua dd brom thấy có 1,12 lít khí không màu thoát ra. Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A ( biết khí đo ở nhiệt độ tiêu chuẩn).
Khí thoát ra ngoài : $CH_4$
$C_2H_2 + 2Br_2 \to C_2H_2Br_4$
$V_{CH_4} = 1,12(lít) \Rightarrow \%V_{CH_4} = \dfrac{1,12}{3,36}.100\% = 33,33\%$
$\%V_{C_2H_2} = 100\% -33,33\% = 66,67\%$
Đúng 4
Bình luận (0)