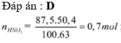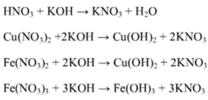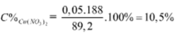Nung m g Cu(OH)2 đến khối lượng không đổi thu được 24 g chất rắn B a: Tính m b: Hòa tan tất cả B thì cần vừa đủ 200ml dung dịch HNO3 . Tính nồng độ mol của HNO3 , Tính khối lượng muối sinh ra khi phản ứng giữa B và HNO3 kết thúc

Những câu hỏi liên quan
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đkct) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 2 : 3). Cho 600 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z thu được chất rắn T. Nung T đến khối lượng không đổi thu được 46,65 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Tí...
Đọc tiếp
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đkct) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 2 : 3). Cho 600 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z thu được chất rắn T. Nung T đến khối lượng không đổi thu được 46,65 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Tính nồng độ % của Fe(NO3)3 trong X và tìm công thức các khí trong B.

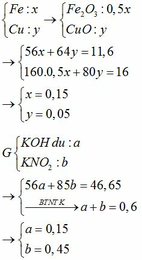
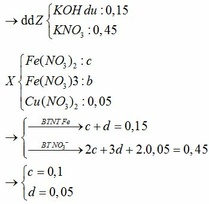

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%
Đúng 0
Bình luận (0)
nhiệt phân hoàn toàn m(g) Cu(OH)2 ta thu được 1 chất rắn màu đen, Hòa tan hoàn toàn chất rắn màu đen cần vừa đủ 100ml dung dịch H2SO4 2M, ta thu được dung dịch có màu xanh lam
a/ tính giá trị m?
b/ tính khối lượng muối thu được sau phản ứng
a)
Cu(OH)2 ➝ CuO + H2O (2)
CuO + H2SO4➝ CuSO4 + H2O (1)
Đổi : 100ml= 0,1lít
Số mol axit sunfuric cần dùng là:
n= CM . V = 0,1 . 2=0,2 mol
Từ (1) ➜ nH2SO4= nCuO= 0,2mol
Khối lượng CuO đã nhiệt phân là:
m= n.M= 0,2. 80=16 (g)
Từ (2)➜nCu(OH)2= nCuO=0,2 mol
Khối lượng đồng hiđroxit đã dùng là:
m= n.M = 0,2.98=19,6 (g)
b)
Từ (1)➙ nCuSO4=nCuO= 0.2mol
Khối lượng muối thu được là:
m=n.M= 0,2 . 160=32 (g)
O
Đúng 1
Bình luận (0)
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lit (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ %...
Đọc tiếp
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lit (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Cu(NO3)2 trong X là
A. 40,69%.
B. 13,56%.
C. 12,20%.
D. 10,54%.
Hoà tan hoàn toàn m g bột Cu trong 800 g dung dịch HNO3 được dung dịch Y và 2,24 lit khí NO (đktc). Y tác dụng vừa đủ với 300 ml dung dịch NaOH 2M được kết tủa R. Sau khi nung R đến khối lượng không đổi thu được 20 g chất rắn.
a. Tính khối lượng Cu ban đầu.
b. Tính khối lượng các chất trong Y và nồng độ % của dung dịch HNO3 đã dùng
nNO = 2,24/22,4 = 0,1 mol; nNaOH = 0,3.0,2 = 0,06 mol
a. Khi cho Y tác dụng với dung dịch NaOH thu được kết tủa R chỉ chứa Cu(OH)2.
Chất rắn thu được khi nung là CuO => nCuO = 20/80 = 0,25 mol
=> nCu(OH )2 = nCuO = 0,25 mol.
Theo định luật bảo toàn nguyên tố:
nCu (ban đầu) = nCu (trong CuO) = 0,25 mol => mCu = 0,25.64 = 16 g
b. Trong X, nCu2+ = nCu(OH)2 = 0,25 mol => mCu(NO3)2 = 188.0,25 = 47 g
Cu → Cu2+ + 2e
0,25 mol 0,5 mol
Mà: N+5 + 3e → N+2
0,3 mol 0,1 mol
Vậy chứng tỏ phản ứng của Cu và HNO3 phải tạo ra NH4NO3.
ne (Cu nhường) = Σne nhận = 0,5 mol => ne nhận N+5 →N-3 = 0,5 – 0,3 = 0,2 mol
N+5 + 8e → N-3
0,2 mol 0,025 mol
nNH4NO3 = 0,025 mol => mNH4NO3 = 80.0,025 = 2 g
Theo định luật bảo toàn nguyên tố:
n HNO3 pư = nN (trong Cu(NO3)2 ) + nN (trong NO) + nN (trong NH4NO3)
= 2nCu(NO3)2 + nNO + 2nNH4NO3 = 0,65 mol
Nếu sử dụng công thức tính nhanh ở trên ta có:
nHNO3 pư = 4.nNO + 10.nNH4NO3 = 4.0,1 + 10.0,25 = 0,65 mol
mHNO3 = 63.0,65 = 40,95 g => C% = 40,95/800.100% = 5,12%
Đúng 3
Bình luận (1)
Hòa tan 17,6 gam hỗn hợp A gồm Fe và Cu vào 227,3 gam dung dịch
H
N
O
3
30%, sau khi kim loại tan hết thu được dung dịch X (không có
N
H
4
+
) và V lít (đktc) hỗn hợp khí B (gồm 2 chất có tỉ lệ mol 2 : 3). Cho 100 ml dung dịch KOH 7,5M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung nóng trong không khí đến khối lượng không đổi thu được 24 gam chất rắn. C...
Đọc tiếp
Hòa tan 17,6 gam hỗn hợp A gồm Fe và Cu vào 227,3 gam dung dịch H N O 3 30%, sau khi kim loại tan hết thu được dung dịch X (không có N H 4 + ) và V lít (đktc) hỗn hợp khí B (gồm 2 chất có tỉ lệ mol 2 : 3). Cho 100 ml dung dịch KOH 7,5M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung nóng trong không khí đến khối lượng không đổi thu được 24 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 62,3 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của F e N O 3 3 trong X là
A. 10,57%
B. 20,80%
C. 40,69%
D. 12,20%
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch
H
N
O
3
50,4%, sau khi kim loại tan hết thu được dung dịch X (không có
N
H
4
+
) và V lít (đktc) hỗn hợp khí B (gồm 2 chất có tỉ lệ mol 3 : 2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung nóng trong không khí đến khối lượng không đổi thu đ...
Đọc tiếp
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch H N O 3 50,4%, sau khi kim loại tan hết thu được dung dịch X (không có N H 4 + ) và V lít (đktc) hỗn hợp khí B (gồm 2 chất có tỉ lệ mol 3 : 2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung nóng trong không khí đến khối lượng không đổi thu được 16 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của trong X là
A. 13,56%
B. 20,20%
C. 40,69%
D. 12,20%
Cho 300 ml dung dịch FeCl3 nồng độ 2M tác dụng vừa đủ với 300 ml d d NaOH.Phản ứng kết thúc lọc tủa đem nung đến khối lượng không đổi thu được chất rắn X a/ Lập PTHH.Tính khối lượng chất rắn X sinh ra b/ Tính nồng độ mol của dung dịch thu được sau phản ứng,coi như thể tích dung dịch thay đổi không đáng kể .
Đọc tiếp
Cho 300 ml dung dịch FeCl3 nồng độ 2M tác dụng vừa đủ với 300 ml d d NaOH.Phản ứng kết thúc lọc tủa đem nung đến khối lượng không đổi thu được chất rắn X
a/ Lập PTHH.Tính khối lượng chất rắn X sinh ra
b/ Tính nồng độ mol của dung dịch thu được sau phản ứng,coi như thể tích dung dịch thay
đổi không đáng kể .
a)
$FeCl_3 + 3NaOH \to Fe(OH)_3 + 3NaCl$
$2Fe(OH)_3 \xrightarrow{t^o} Fe_2O_3 + 3H_2O$
$n_{FeCl_3} = 0,3.2 = 0,6(mol)$
Theo PTHH : $n_{Fe_2O_3} = \dfrac{1}{2}n_{FeCl_3} = 0,3(mol)$
$\Rightarrow m_{Fe_2O_3} = 0,3.160 = 48(gam)$
b) Sau phản ứng, $V_{dd} = 0,3 + 0,3 = 0,6(lít)$
$n_{NaCl} = 3n_{FeCl_3} = 1,8(mol) \Rightarrow C_{M_{NaCl}} = \dfrac{1,8}{0,6} = 3M$
Đúng 0
Bình luận (0)
Trộn 200ml dung dịch CuCl2 với 300ml dung dịch NaOH có nồng độ 0.2M sau phản ứng lọc kết tủa và nung khối lượng không đổi a, viết phương trình phản ứng xảy ra b, tính khối lượng chất rắn thu được sau khi nung c, tính nồng độ mol dung dịch sau phản ứng
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lit (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ %...
Đọc tiếp
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lit (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Fe(NO3)3 trong X là
A. 12,20%
B. 13,56%
C. 20,20%
D. 40,69%.
Đáp án : B
Vì kim loại tan hết nên HNO3 dư
Khi X + KOH => thu được kết tủa
+) Giả sử KOH dư => chất rắn 16,0g gồm Fe2O3 ; CuO (*)
Khi đó T gồm KNO3 và KOH => Nung lên thành KNO2 và KOH với số mol lần lượt là x và y
=> 41,05 = 85x + 56y
Và nK = 0,5 = x + y
=> x = 0,45 mol ; y = 0,05 mol
Gọi số mol Fe và Cu trong A lần lượt là a và b mol
=> 56a + 64b = 11,6g
Và 80a + 80b = 16g (*)
=> a = 0,15 mol ; b = 0,05 mol
+) Nếu chỉ có Fe3+ và Cu2+ => nKOH < 3nFe + 2nCu ( Vô lí )
=> Trong X có Fe2+ : u mol và Fe3+ : v mol
=> HNO3 phải hết
=> u + v = 0 , 15 2 u + 3 v = 0 , 45 => u = 0 , 1 v = 0 , 05
Có nFe(NO3)3 = 0,05 mol
Ta thấy mN2 < mB < mNO2
=> 0,35.28 < mB < 46.0,7
=> 9,8 < mB < 32,2g
BTKL : 66,9g < mdd sau < 89,3g
=> 13,55% < %mFe(NO3)3 < 18,09%
Đúng 0
Bình luận (0)