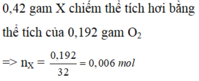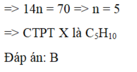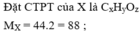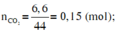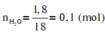Oxi hoá hêt 1,48g chất A. Dẫn toàn bộ sản phẩm cháy lần lượt vào bình I đựng H2SO4 đặc và bình II đựng KOH đặc thì thấy khối lượng bình I tăng 1,8g và bình II tăng 3,52g. Công thức phân tử của A là gì? Biết MA = 74đvC.

Những câu hỏi liên quan
Đốt cháy hoàn toàn 2 hiđrocacbon X và Y kế tiếp nhau trong cùng dãy đồng đẳng. Dẫn sản phẩm cháy lần lượt qua bình (I) đựng H2SO4 đặc và bình (II) đựng Ca(OH)2 thấy khối lượng dung dịch bình (I) tăng 2,02 gam và bình (II) giảm 4,4 gam. Vậy công thức phân tử của X, Y A. C2H4 và C3H8 B. C2H2 và C3H4 C. C2H6 và C3H8 D. C3H8 và C4H10
Đọc tiếp
Đốt cháy hoàn toàn 2 hiđrocacbon X và Y kế tiếp nhau trong cùng dãy đồng đẳng. Dẫn sản phẩm cháy lần lượt qua bình (I) đựng H2SO4 đặc và bình (II) đựng Ca(OH)2 thấy khối lượng dung dịch bình (I) tăng 2,02 gam và bình (II) giảm 4,4 gam.
Vậy công thức phân tử của X, Y
A. C2H4 và C3H8
B. C2H2 và C3H4
C. C2H6 và C3H8
D. C3H8 và C4H10
Dẫn sản phẩm cháy qua bình (I) đựng H2SO4 đặc thấy khối lượng bình (I) tăng 2,02 gam ⇒ mH2O = 2,02 ⇒ nH2O = 101/900
Dẫn sản phẩm cháy qua bình (II) đựng Ca(OH)2 thấy khối lượng bình (II) giảm 4,4 gam ⇒ mCaCO3 – mCO2 = 4,4. Ta có: nCO2 = nCaCO3
⇒ nCO2.(100 – 44) = 4,4 ⇒ nCO2 = 11/140
nH2O > nCO2 ⇒ 2 Hidrocacbon đó là ankan
Gọi công thức chung của 2 chất đó là CnH2n+2 (n>1)
Ta có: n CO2 : n H2O = n : (n+1) = 101/900 : 11/140 ⇒ n = 2,33
mà 2 ankan đồng đẳng kế tiếp ⇒ 2 chất đó là C2H6 và C3H8
Đáp án C.
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 1 hidrocacbon A ( là chất khí, đkc) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 chứa NaOH dư người ta thấy khối lượng bình I tăng 1,8g và khối lượng bình 2 tăng 3,52 gam. XĐ CTPT của A. A. C4H10 B. C3H8 C. C5H12 D. C6H14
Đọc tiếp
Đốt cháy hoàn toàn 1 hidrocacbon A ( là chất khí, đkc) rồi dẫn sản phẩm lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 chứa NaOH dư người ta thấy khối lượng bình I tăng 1,8g và khối lượng bình 2 tăng 3,52 gam. XĐ CTPT của A.
A. C4H10
B. C3H8
C. C5H12
D. C6H14
Đáp án A
Khối lượng bình 1 tăng là khối lượng của H2O => nH2O = 1,8/18 = 0,1 mol
Khối lượng bình 2 tăng là khối lượng của CO2 => nCO2 = 3,52/44 = 0,08 mol
Nhận thấy: nCO2 < nH2O => hidrocacbon là ankan;
Số mol ankan là nankan = 0,1 – 0,08 = 0,02 mol
Phương trình phản ứng:
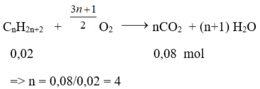
CTPT của A là C4H10
Đúng 0
Bình luận (0)
Đốt cháy 3g HCHC X ,dẫn toàn bộ sản phẩm cháy qua bình 1 đựng H2SO4 đặc, bình 2 đựng dung dịch KOH dư, thấy bình 1 tăng thêm 1,8g, bình 2 tăng thêm 3,52g và còn lại 448 ml khí N2 ở đktc. Tỉ khối hơi của X đối với không khí là 2,586. Tìm CTPT của X.
\(m_{b1\uparrow}=m_{H_2O}=1,8\left(g\right)\Rightarrow n_{H_2O}=0,1\left(mol\right)\)
=> \(n_H=0,2\left(mol\right)\)
\(m_{b2\uparrow}=m_{CO_2}=3,52\left(g\right)\Rightarrow n_{CO_2}=0,08\left(mol\right)\)
=> \(n_C=0,08\left(mol\right)\)
\(n_{N_2}=0,02\left(mol\right)\Rightarrow n_N=0,04\left(mol\right)\)
Ta có : \(m_O=3-\left(0,08.12+0,2+0,04.14\right)=1,28\left(g\right)\)
=> \(n_O=0,08\left(mol\right)\)
\(M_X=2,586.29=75\)
Đặt CT của X là CxHyOzNt (x,y,z,t >0)
Ta có : \(x:y:z:t=0,08:0,2:0,08:0,04=2:5:2:1\)
=> CTĐGN : \(\left(C_2H_5O_2N\right)_n\)
Ta có : 75n=75
=> n=1
Vậy CTPT của X là C2H5O2N
Đúng 2
Bình luận (1)
Đốt cháy hoàn toàn 1,32g chất hữu cơ X rồi dẫn sản phẩm cháy qua bình I chứa H2SO4 đặc và dư và bình II đựng dd KOH thấy khối lượng bình I tăng 1,08g, khối lượng bình II tăng thêm 2,64g.a.Xác định CTPT của X biết X là este tạo bởi axit và rượu đều đơn chức và mạch hởb.Đun 3,3g este X với dd NaOH dư cho đến khi phản ứng, người ta thu được 3,075g muối khan. Xác định CTCT của X
Đọc tiếp
Đốt cháy hoàn toàn 1,32g chất hữu cơ X rồi dẫn sản phẩm cháy qua bình I chứa H2SO4 đặc và dư và bình II đựng dd KOH thấy khối lượng bình I tăng 1,08g, khối lượng bình II tăng thêm 2,64g.
a.Xác định CTPT của X biết X là este tạo bởi axit và rượu đều đơn chức và mạch hở
b.Đun 3,3g este X với dd NaOH dư cho đến khi phản ứng, người ta thu được 3,075g muối khan. Xác định CTCT của X
Oxi hoá hoàn toàn 0,60(g) một ancol A đơn chức bằng oxi không khí, sau đó dẫn sản phẩm qua bình 91 đựng H2SO4 đặc rồi dẫn tiếp qua bình (2) đựng KOH. Khối lượng bình (1) tăng 0,72g; bình (2) tăng 1,32g. Tìm công thức phân tử, viết công thức cấu tạo có thể có của A.
CTCT có thể có của A là:
CH3-CH2-CH2-OH, CH3-CH(OH)-CH3
Đúng 0
Bình luận (0)
Oxi hóa hoàn toàn 1,5g chất hữu cơ X rồi dẫn toàn bộ sản phẩm thu được lần lượt qua bình một đựng H2SO4 đặc và bình hai đựng KOH dư. Ta thấy khối lượng bình một tăng 2,7g và bình hai tăng 4,4g. Xác định CTPT của X ? Biết rằng tỷ khối hơi của X so với H2 là 15.
Đốt cháy hoàn toàn 0,42 gam hợp chất hữu cơ X rồi dẫn toàn bộ sản phẩm cháy (chỉ gồm CO2 và H2O) lần lượt qua bình (1) đựng H2SO4 đặc dư, bình (2) đựng dung dịch KOH dư. Kết thúc thí nghiệm thấy khối lượng bình (1) và bình (2) tăng lần lượt là 0,54 gam và 1,32 gam. Biết rằng 0,42 gam X chiếm thể tích hơi bằng thể tích của 0,192 gam O2 ở cùng điều kiện nhiệt độ và áp suất. Công thức phân tử của X là
A
.
C
5
H...
Đọc tiếp
Đốt cháy hoàn toàn 0,42 gam hợp chất hữu cơ X rồi dẫn toàn bộ sản phẩm cháy (chỉ gồm CO2 và H2O) lần lượt qua bình (1) đựng H2SO4 đặc dư, bình (2) đựng dung dịch KOH dư. Kết thúc thí nghiệm thấy khối lượng bình (1) và bình (2) tăng lần lượt là 0,54 gam và 1,32 gam. Biết rằng 0,42 gam X chiếm thể tích hơi bằng thể tích của 0,192 gam O2 ở cùng điều kiện nhiệt độ và áp suất. Công thức phân tử của X là
A . C 5 H 10 O
B . C 5 H 10
C . C 4 H 6 O
D . C 3 H 2 O 2
Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch
H
2
SO
4
đặc, bình (2) đựng dung dịch KOH dư. Sau thí nghiệm, khối lượng bình (1) tăng 1,8 gam, khối lượng bình (2) tăng 6,6 gam. Tỉ khối của X đối với hiđro là 44. Xác định công thức của phân tử X A.
C
2
H
4...
Đọc tiếp
Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch H 2 SO 4 đặc, bình (2) đựng dung dịch KOH dư. Sau thí nghiệm, khối lượng bình (1) tăng 1,8 gam, khối lượng bình (2) tăng 6,6 gam. Tỉ khối của X đối với hiđro là 44. Xác định công thức của phân tử X
A. C 2 H 4 O
B. C 5 H 12 O
C. C 4 H 8 O 2
D. C 3 H 4 O 3
Đốt cháy hoàn toàn 2,4 g chất hữu cơ A, dẫn toàn bộ sản phẩm cháy thu được lần lượt qua các bình H2SO4 đặc và Ba(OH)2 dư thì thấy các bình tăng lần lượt là 5,4 g và 6,6 g xác định công thức phân tử của a biết tỉ khối hơi của A so với khí oxi là 0,5 Giải giúp mình với! Mình cảm ơn
Ta có: \(\left\{{}\begin{matrix}m_{H_2O}=5,4\left(g\right)\\m_{CO_2}=6,6\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\\n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_H=2n_{H_2O}=0,6\left(mol\right)\\n_C=n_{CO_2}=0,15\left(mol\right)\end{matrix}\right.\)
`=> m_C + m_H = 0,15.12 + 0,6 = 2,4 (g) = m_A`
`=> A` không chứa O
\(M_A=0,5.32=16\left(g/mol\right)\)
Ta có: \(n_C:n_H=0,15:0,6=1:4\)
`=>` CTPT của A có dạng \(\left(CH_4\right)_n\)
\(\Rightarrow n=\dfrac{16}{16}=1\)
Vậy A là CH4
Đúng 1
Bình luận (0)