Dung dịch X có 0,1 mol K+; 0,2 mol Mg2+; 0,1 mol Na+; 0,2 mol Cl- và a mol Y-. Ion Y- và giá trị của a là
A. NO3- và 0,4
B. OH- và 0,2
C. OH- và 0,4
D. NO3- và 0,2
Một dung dịch có chứa các ion: NH 4 + (0,1 mol), K + (0,15 mol), NO 3 - (0,1 mol), và CO 3 2 - (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch BaCl 2 thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Chọn B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
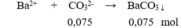
m↓ = 0,075.197 = 14,775 gam.
Dung dịch X có 0,1 mol K+; 0,2 mol Mg2+; 0,1 mol Na+; 0,2 mol Cl- và a mol Y-. Cô cạn dung dịch X thu được m gam muối khan. Ion Y- và giá trị của m là?
A. OH- và 30,3
B. NO3- và 23,1
C. NO3- và 42,9
D. OH- và 20,3
Đáp án : C
Bảo toàn điện tích trong dung dịch: nY = 0,1 + 0,2. 2 + 0,1 – 0,2 = 0,4 mol
Đáp số cho ta hai ion Y- là và , nhưng loại vì nó không thể tồn tại trong cùng 1 dung dịch với ion
mmuối = 0,1. 39 + 0,2. 24 + 0,1. 23 + 0,2. 35,5 + 0,4. 62 = 42,9 g
Dung dịch X có 0,1 mol K+; 0,2 mol Mg2+; 0,1 mol Na+; 0,2 mol Cl- và a mol Y-. Ion Y- và giá trị của a là
A. NO3- và 0,4.
B. OH- và 0,2.
C. OH- và 0,4.
D. NO3- và 0,2.
Vì có Mg2+ nên dung dịch không có OH- → Loại B và C
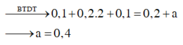
Đáp án A
Một dung dịch Y có chứa các ion: Mg2+ (0,05 mol), K+ (0,15 mol), NO3- (0,1 mol), và SO42- (x mol). Khối lượng chất tan có trong dung dịch Y là
Áp dụng định luật bảo toàn điện tích: tổng số mol điện tích dương bằng tổng số mol điện tích âm
nên 2.0,05+ 0,15.1= 0,1.1+ 2x → x= 0,075 mol
Một dung dịch Y có chứa các ion: Mg2+ (0,05 mol), K+ (0,15 mol), NO3- (0,1 mol), và SO42- (x mol). Khối lượng chất tan có trong dung dịch Y là
Cho 200 ml dung dịch X chứa các ion NH4+ (0,5M), K+ (0,1M), SO42- (0,25M), Cl- (aM). Biết rằng dung dịch X được điều chế bằng cách hoà tan 2 muối vào nước. Khối lượng của 2 muối được lấy là
giải dùm mình cần gấp tối nay lúc 10h giúp dùm mình cần gấp
Dung dịch X có chứa K+ (0,1 mol); Fe3+ (0,2 mol), NO 3 - (0,4 mol), SO 4 2 + (x mol). Cô cạn dung dịch X được m gam hỗn hợp 4 muối khan. Giá trị của m là
A. 39,9
B. 54,3
C. 47,8
D. 68,7
Bảo toàn điện tích: 2x = 0,1 + 0,2.3 – 0,4 = 0,3 → x = 0,15 mol
![]()
→ m = 0,1.39 + 0,2.56 + 0,4.62 + 0,15.96 = 54,3 gam
Đáp án B
Dung dịch X có chứa K+ (0,1 mol); Fe3+ (0,2 mol), N O 3 - (0,4 mol), S O 4 2 - (x mol). Cô cạn dung dịch X được m gam hỗn hợp 4 muối khan. Giá trị của m là
A. 39,9
B. 54,3
C. 47,8
D. 68,7
Đáp án B
Bảo toàn điện tích: 2x = 0,1 + 0,2.3 – 0,4 = 0,3 → x = 0,15 mol
m = m K + + m F e 3 + + m N O 3 - + m S O 4 2 -
=> m= 0,1.39+0,2.56+0,4.62+0,15.96= 54,3 gam
Dung dịch X gồm 0,1 mol K+; 0,2 mol Mg2+; 0,1 mol Na+; 0,2 mol Cl- và a mol Y2-. Cô cạn dung dịch X thu được m gam muối khan. Ion Y2- và giá trị của m là:
A. CO32- và 30,1
B. SO42- và 56,5
C. CO32- và 42,1
D. SO42- và 37,3
Đáp án D
Để dung dịch tồn tại thì ion Y2- là SO42-
Theo định luật bảo toàn điện tích: 0,1.1+ 0,2.2+0,1.1=0,2+ 2a
Suy ra a= 0,2
Muối khan thu được là: 0,1.39+ 0,2.24+ 0,1.23+0,2.35,5+ 0,2.96= 37,3 gam
Dung dịch X gồm 0,1 mol K+; 0,2 mol Mg2+; 0,1 mol Na+; 0,2 mol Cl- và a mol Y2-. Cô cạn dung dịch X, thu được m gam muối khan. lon Y2- và giá trị của m là
A. C O 3 2 - và 42,1
B. S O 4 2 - và 37,3
C. S O 4 2 - và 56,5
D. C O 3 2 - và 30,1
Quan sát 4 đáp án ta thấy
![]()
Vì dung dịch tồn tại 0,2 mol Mg2+ mà MgCO3 là chất kết tủa do đó Y sẽ là ![]() . Áp dụng định luật bảo toàn điện tích ta có
. Áp dụng định luật bảo toàn điện tích ta có
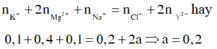
Khối lượng muối bằng tổng khối lượng của các ion trong dung dịch:
![]() gam
gam
Đáp án B.