Dung dịch X có chứa K+ (0,1 mol); Fe3+ (0,2 mol), N O 3 - (0,4 mol), S O 4 2 - (x mol). Cô cạn dung dịch X được m gam hỗn hợp 4 muối khan. Giá trị của m là
A. 39,9
B. 54,3
C. 47,8
D. 68,7
Một dung dịch có chứa các ion: NH 4 + (0,1 mol), K + (0,15 mol), NO 3 - (0,1 mol), và CO 3 2 - (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch BaCl 2 thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Chọn B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
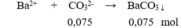
m↓ = 0,075.197 = 14,775 gam.
Một dung dịch Y có chứa các ion: Mg2+ (0,05 mol), K+ (0,15 mol), NO3- (0,1 mol), và SO42- (x mol). Khối lượng chất tan có trong dung dịch Y là
Cho 200 ml dung dịch X chứa các ion NH4+ (0,5M), K+ (0,1M), SO42- (0,25M), Cl- (aM). Biết rằng dung dịch X được điều chế bằng cách hoà tan 2 muối vào nước. Khối lượng của 2 muối được lấy là
giải dùm mình cần gấp tối nay lúc 10h giúp dùm mình cần gấp
Một dung dịch Y có chứa các ion: Mg2+ (0,05 mol), K+ (0,15 mol), NO3- (0,1 mol), và SO42- (x mol). Khối lượng chất tan có trong dung dịch Y là
Áp dụng định luật bảo toàn điện tích: tổng số mol điện tích dương bằng tổng số mol điện tích âm
nên 2.0,05+ 0,15.1= 0,1.1+ 2x → x= 0,075 mol
Dung dịch X có chứa K+ (0,1 mol); Fe3+ (0,2 mol), NO 3 - (0,4 mol), SO 4 2 + (x mol). Cô cạn dung dịch X được m gam hỗn hợp 4 muối khan. Giá trị của m là
A. 39,9
B. 54,3
C. 47,8
D. 68,7
Bảo toàn điện tích: 2x = 0,1 + 0,2.3 – 0,4 = 0,3 → x = 0,15 mol
![]()
→ m = 0,1.39 + 0,2.56 + 0,4.62 + 0,15.96 = 54,3 gam
Đáp án B
Có hai dung dịch, mỗi dung dịch chứa hai cation và hai anion trong số các ion sau: K+ (0,15 mol); Mg2+ (0,1 mol); NH4+ (0,25 mol); H+ (0,2 mol); Cl- (0,1 mol); SO42- (0,075 mol); NO3- (0,25 mol) và CO32- (0,15 mol). Một trong hai dung dịch chứa:
A. NH4+, H+, NO3-, CO32-.
B. K+, NH4+, Cl- và CO32-.
C. K+, Mg2+, Cl-, SO42-.
D. Mg2+, H+, NO3- và CO32-.
Đáp án B
Loại ngay A và D do H+ và CO32- không tồn tại trong cùng 1 dung dịch
Xét B: nK+ + nNH4+ = 0,15 + 0,25 = 0,4 mol; nCl- + 2nCO32- = 0,1 + 2.0,15 = 0,4 mol
=> thỏa mãn định luật bảo toàn điện tích
Xét C: nK+ + 2nMg2+ = 0,15 + 2.0,1 = 0,35 mol; nCl- + 2nSO42- = 0,1 + 2.0,075 = 0,25 mol
=> không thỏa mãn định luật bảo toàn điện tích
Một dung dịch có chứa các ion: Mg 2 + (0,05 mol), K + (0,15 mol), NO 3 - (0,1 mol) và SO 4 2 - (x mol). Giá trị của x là
A. 0,05
B. 0,075
C. 0,1
D. 0,15
Một dung dịch có chứa các ion: 0,05 mol Mg2+; 0,15 mol K+; 0,1 mol NO3- và x mol SO42-. Giá trị của x là:
A. 0,05.
B. 0,075.
C. 0,1
D. 0,15.
Đáp án B
Bảo toàn điện tích, ta có: 0,05.2 + 0,15 = 0,1 + 2x => x = 0,075 => Chọn B.
Một dung dịch có chứa các ion: Mg2+ (0,05 mol), K+ (0,15 mol), NO3- (0,1 mol) và SO42- (x mol). Giá trị của x là
A. 0,05.
B. 0,075.
C. 0.1.
D. 0,15.
Bảo toàn điện tích → 0,05.2 + 0,15.1 = 0,1.1 + 2x → x = 0,075
Đáp án B
Một dung dịch có chứa các ion: Mg2+ (0,05 mol), K+ (0,15 mol), NO3- (0,1 mol) và SO42- (x mol). Giá trị của x là
A. 0,05
B. 0,075
C. 0.1
D. 0,15
Đáp án B
Bảo toàn điện tích => 0,05.2 + 0,15.1 = 0,1.1 + 2x => x = 0,075