Dung dịch X gồm CH3COOH 0,03M và CH3COONa 0,01M. Biết ở 250C; Ka của CH3COOH là 1,75.10-5; bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 250C là:
A. 4,28
B. 4,04
C. 4,76
D. 6,28
Cho dung dịch X chứa hỗn hợp gồm CH3COOH 0,1 M và CH3COONa 0,1 M. Biết ở 25°C, K của CH3COOH là 1,75.10-5 và bỏ qua sự phân li của nước. Giá trị pH của dung dịch X ở 25°C là:
A. 1,00
B. 4,24
C. 2,88
D. 4,76
Vì muối CH3COONa là chất điện li mạnh nên ta có
![]()
Do đó sau quá trình trên trong dung dịch có nồng độ của ion CH3COO- là 0,1.
Xét cân bằng điện li: CH3COOH + H2O ⇌ CH3COO- + H3O+
Nồng độ ban đầu: 0,1 0,1 0
Nồng độ phân li: x(M) → x x
Nồng độ cân bằng: 0,1 – x 0,1 + x x
Thay các giá trị ở trạng thái cân bằng vào công thức tính hằng số điện li thì ta có
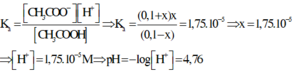
Đáp án D.
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH; CH3COOH; HCl; C6H5OH (phenol) và pH của các dung dịch trên được ghi trong bảng sau:
| Chất |
X |
Y |
Z |
T |
| pH (dung dịch nồng độ 0,01M ở 250C |
6,48 |
3,22 |
2,00 |
3,45 |
Nhận xét nào sau đây đúng ?
A. Z tạo kết tủa trắng với dung dịch AgNO3
B. T có khả năng phản ứng tráng bạc
C. X được điều chế trực tiếp từ ancol etylic
D. Y tạo kết tủa trắng với nước brom
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH, C6H5NH2 (anilin), CH3COOH và HCl. Ở 250C, pH của các dung dịch (cùng có nồng độ 0,01M) được ghi lại trong bảng sau: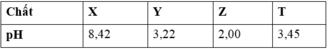
Nhận xét nào dưới đây là đúng?
A. X có phản ứng tráng gương
B. Y có thể điều chế trực tiếp từ ancol etylic
C. Z tạo kết tủa trắng với nước Br2.
D. T có thể dùng trong công nghiệp thực phẩm
Dựa vào bảng giá trị pH ta có : X là C6H5NH2; Y là HCOOH; Z là HCl; T là CH3COOH
→ Đáp án D
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH; CH3COOH; HCl; C6H5OH.
Giá trị pH của các dung dịch trên cùng nồng độ 0,01M, ở 250C đo được như sau:
![]()
Nhận xét nào sau đây đúng?
A. Y tạo kết tủa trắng với nước brom
B. X được điều chế trực tiếp từ ancol etylic
C. T có thể cho phản ứng tráng gương
D. Z tạo kết tủa trắng với dung dịch AgNO3
Chọn đáp án D
Về tính axit thì HCl > HCOOH > CH3COOH > C6H5OH
Và về PH : Z < Y < T < X
A. HCOOH tạo kết tủa trắng với nước brom → Sai
B. C6H5OH được điều chế trực tiếp từ ancol etylic → Sai
C. CH3COOH có thể cho phản ứng tráng gương → Sai
D. HCl tạo kết tủa trắng với dung dịch AgNO3 → Đúng (kết tủa là AgCl)
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH, C6H5NH2 (anilin), CH3COOH và HCl. Ở 250C, pH của các dung dịch (cùng có nồng độ 0,01M) được ghi lại trong bảng sau:
| Chất |
X |
Y |
Z |
T |
| pH |
8,42 |
3,22 |
2,00 |
3,45 |
Nhận xét nào dưới đây là đúng?
A. X có phản ứng tráng gương.
B. Y có thể điều chế trực tiếp từ ancol etylic.
C. Z tạo kết tủa trắng với nước Br2.
D. T có thể dùng trong công nghiệp thực phẩm.
Đáp án D
Dựa vào bảng giá trị pH ta có : X là C6H5NH2; Y là HCOOH; Z là HCl; T là CH3COOH
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất HCOOH; CH3COOH; HCl; C6H5OH (phenol) và pH của các dung dịch trên được ghi trong bảng sau:
| Chất |
X |
Y |
Z |
T |
| pH ( dung dịch nồng độ 0,01M, 250C) |
6,48 |
3,22 |
2,00 |
3,45 |
Nhận xét nào sau đây đúng?
A. X được điều chế trực tiếp từ ancol etylic
B. Y có phản ứng tráng gương
C. Z tạo kết tủa trắng với nước brom
D. T cho phản ứng tráng gương
Đáp án : B
Dựa vào tính axit thì HCl mạnh nhất , C6H5OH yếu nhất
HCOOH và CH3COOH tính axit trung bình yếu.
VÌ CH3COOH có nhóm CH3 đẩy e giảm độ pân cực liên kết O-H
=> tính axit yếu hơn HCOOH => pH cao hơn
=> X : HCl ; Y : HCOOH ; Z : CH3COOH ; T : C6H5OH
Mọi người giải giúp mk đc ko ạ
Câu 1: Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M, thu được 2V ml dung dịch Y. Dung dịch Y có pH bằng
Câu 2: Khi trộn những thể tích bằng nhau của dung dịch HNO3 0,01M và dung dịch NaOH 0,03M thì thu được dung dịch có giá trị pH bằng
Câu 3: Trộn 100 ml dung dịch gồm Ba(OH)2 0,1M và NaOH 0,1M với 400 ml dung dịch gồm H2SO4 0,0375M và HCl 0,0125M thu được dung dịch X. Giá trị pH của dung dịch X là
Câu 4: Hòa tan m gam Na vào nước được 100 ml dung dịch có pH = 13. Giá trị của m bằng
Câu 5: Để trung hoà 100 gam dung dịch HCl 1,825% cần bao nhiêu ml dung dịch Ba(OH)2 có pH bằng 13?
Câu 6: Trộn 200 ml dung dịch hỗn hợp gồm HNO3 0,3M và HClO4 0,5M với 200 ml dung dịch Ba(OH)2 aM, thu được dung dịch có pH = 3. Vậy a có giá trị là
Câu 7: Trộn 100 ml dung dịch có pH=1 gồm HCl và HNO3 với 100 ml dung dịch NaOH nồng độ a (mol/l), thu được 200 ml dung dịch có pH=12. Giá trị của a
Câu 8: Trộn 250 ml dung dịch chứa hỗn hợp HCl 0,08M và H2SO4 0,01M với 250 ml dung dịch NaOH aM thu được 500 ml dung dịch có pH = 12. Giá trị a là
Câu 9: Trộn 3 dung dịch H2SO4 0,1M, HCl 0,2M và HNO3 0,3M với thể tích bằng nhau, thu được dung dịch X. Cho 300 ml dung dịch X tác dụng với V lít dung dịch Y chứa NaOH 0,2M và Ba(OH)2 0,1M được dung dịch Z có pH = 1. Giá trị của V là
Câu 10: Trộn 100ml dd H2SO4 0,01M với 400ml dd Ba(OH)2 nồng độ a mol/l thu được m gam kết tủa và dd còn lại có pH=12. Giá trị của m và a là
Câu 11: Trộn 300ml dd HCl 0,05M với 200ml dd Ba(OH)2 nồng độ a mol/l thu được 500ml dd có pH=x. Cô cạn dd sau phản ứng thu được 1,9875 gam chất rắn. Giá trị của a và x lần lượt là
Câu 12: Trộn 150 ml dd HCl nồng độ a mol/l với 250 ml dd hỗn hợp gồm NaOH 0,5M và Ba(OH)2 0,1M thu được dd có pH=12. Giá trị của a là
Câu 13: Trộn 250 ml dd hỗn hợp gồm HCl 0,08M và H2SO4 0,01M với 250 ml dd NaOH nồng độ b mol/l được 500 ml dd có pH=12. Giá trị của b là
Câu 14: Trộn 250 ml dd hỗn hợp gồm HCl 0,08M và H2SO4 0,01M với 250 ml dd Ba(OH)2 nồng độ x mol/l thu được m gam kết tủa và 500 ml dd có pH=12 . Giá trị của m và x tương ứng là
Câu 1: nOH-=0,01V(mol) nH+ =0,03V(mol)
nOH-<nH+ nên axit dư -->nH+dư =0,02V(mol)--->CM H+=0,01(M)=10-2->pH=2
Chú thích do thể tích như nhau nên ko cần đổi
Câu 2:nOH-=0,03a(mol) nH+=0,01a(mol)-->OH-dư
noh-dư=0,02a(mol) mà v=2a-->Cm oh-=0,01=10-2(M)->pH=12
Câu 3:nOH-=0,03 nH+=0,035->H+dư nH+dư=0,005 mol
V=0,5(l) CmH+=10^-2 pH=2
thầy cho em hỏi cách tính pH của dung dịch đệm ạ
tính pH của dung dịch đệm gồm CH3COOH 0.1M và CH3COONa 0.1M biết hằng số điện li của CH3COOH là 1,76.10^-5
HD:
CH3COOH \(\leftrightarrow\) CH3COO- + H+
Ban đầu: 0,1 M 0,1 M 0
Cân bằng: 0,1-x 0,1+x x
Hằng số cb: ka = [CH3CO-][H+]/[CH3COOH] = (0,1+x).x/(0,1-x) = 1,76.10-5. Giải pt thu được x, mà [H+] = x nên pH = -log[H+] = -log(x).
em cũng có thể dùng công thức pH= -LogKa + Log(Cb/Ca)
với Cb,Ca là nồng độ bazo và axit
đấy là công thức gần đúng, trong một số trường hợp cần sự chính xác thì công thức đó ko dùng được
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH; CH3COOH, HCl; C6H5OH(phenol) và pH của các dung dịch trên được ghi trong bảng sau
| Chất |
X |
Y |
Z |
T |
| pH dd nồng độ 0,01M, 250C |
6,48 |
3,22 |
2,00 |
3,45 |
Nhận xét nào sau đây đúng?
A. T cho được phản ứng tráng bạc.
B. X được điều chế trực tiếp từ ancol etylic.
C. Y tạo kết tủa trắng với nước brom.
D. Z tạo kết tủa trắng với dung dịch AgNO3 .
Đáp án D
Tính axit tăng dần theo thứ tự: C6H5OH < CH3COOH < HCOOH< HCl
Xét cùng nồng độ mol dung dịch => lực axit yếu hơn sẽ có pH lớn hơn
→ X : C6H5OH; Y : HCOOH ; Z : HCl ; T :CH3COOH
→ Z tạo kết tủa trắng với AgNO3 tạo AgCl