Cho a gam Mg vào 100 ml dung dịch A l N O 3 3 2M và C u N O 3 2 3M thu được 21,36 gam chất rắn. Giá trị của a là
A. 10,08
B. 7,2
C. 10,8
D. 18
Làm Giúp Mk vs ....... Thak Trc Na :) :) :) :v
Câu 4. Hoà tan m gam hỗn hợp Na 2 CO 3 và KHCO 3 vào nước để được 400 ml dung dịch X. Cho từ từ 150 ml
dung dịch HCl 1M vào dung dịch X, thu được dung dịch Y và 1,008 lít khí (đktc). Cho Y tác dụng với
Ba(OH) 2 dư, thu được 29,55 gam kết tủa. Giá trị của m là
A. 10,60.
B. 20,13.
C. 11,13.
D. 13,20.
Câu 5. Hai cốc đựng dung dịch HCl đặt trên hai đĩa cân X, Y, cân ở trạng thái cân bằng. Cho 5 gam CaCO 3
vào cốc X và 4,784 gam M 2 CO 3 (M là kim loại kiềm) vào cốc Y. Sau khi hai muối đã tan hoàn toàn, cân trở lại
vị trí thăng bằng. Kim loại M là
A. K.
B. Cs
C. Li
D. Na
Câu 6. Cho dung dịch NaOH dư vào 100 ml dung dịch X chứa đồng thời Ba(HCO 3 ) 2 0,5M và BaCl 2 0,4M thì
thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 19,7.
C. 14,775.
D. 17,73.
Câu 7. Cho từ từ dung dịch chứa 0,2 mol HCl vào dung dịch chứa m gam hỗn hợp X gồm Na 2 CO 3 , KHCO 3 thì
thấy có 0,1 mol khí CO 2 thoát ra. Cho dung dịch Ca(OH) 2 dư vào m / 2 gam hỗn hợp X như trên thấy có 15 gam
kết tủa. Giá trị của m là
A. 31,20.
B. 30,60.
C. 39,40.
D. 19,70.
Câu 8. Cho 100 ml dung dịch chứa hỗn hợp Ba(OH) 2 1M và KOH 2M vào 100 ml dung dịch chứa hỗn hợp
NaHCO 3 2M và NH 4 HCO 3 1M. Sau khi phản ứng xẩy ra hoàn toàn, đun nóng hỗn hợp sau phản ứng cho khí
thoát ra hết thì khối lượng dung dịch sau phản ứng giảm bao nhiêu gam so với tổng khối lượng hai dung dịch
tham gia phản ứng? (biết nước bay hơi không đáng kể).
A. 19,7 gam.
B. 12,5 gam.
C. 25,0 gam.
D. 21,4 gam.
Câu 9. Hấp thụ hoàn toàn 4,48 lít CO 2 (đktc) vào 200ml dung dịch chứa Na 2 CO 3 0,5M và NaOH 0,75M thu
được dung dịch X. Cho dung dịch BaCl 2 dư vào dung dịch X thu được kết tủa có khối lượng là
A. 19,7 gam.
B. 39,4 gam
C. 29,55 gam
D. 9,85 gam.
Câu 10. Trên hai đĩa cân đã thăng bằng, đặt hai cốc bằng nhau: Cho vào cốc bên trái 12 gam Mg; cho vào cốc
bên phải 26,94 gam MgCO 3 , cân mất thăng bằng. Muốn cân trở lại thăng bằng như cũ phải thêm vào cốc Mg
bao nhiêu gam dung dịch HCl 14,6% ?
A. 16 gam.
B. 14 gam.
C. 15 gam.
D. 17 gam.
9): n(CO2) = 4,48/22,4 = 0,2mol
Số mol mỗi chất trong hỗn hợp dung dịch ban đầu:
n(Na2CO3) = 0,5.0,2 = 0,1mol; n(NaOH) = 0,75.0,2 = 0,15mol
Khi cho CO2 vào dung dịch chứa Na2CO3 và NaOH thứ tự các phản ứng xảy ra:
2NaOH + CO2 → Na2CO3 + H2O
0,15 0,075 0,075
CO2 + Na2CO3 + H2O → 2NaHCO3
0,125 0,125 0,25
Số mol Na2CO3 có trong dung dịch X:
n(Na2CO3) = 0,1 + 0,075 - 0,125 = 0,05mol
Cho dung dịch BaCl2 dư vào dung dịch X:
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
0,05 0,05
Khối lượng kết tủa thu được: m(BaCO3) = 0,05.197 = 9,85gam
1) Dung dịch A chứa CO32- (x mol) và HCO3- (y mol)
CO32- + H+ —> HCO3-
x…………x………….x
HCO3- + H+ —> CO2 + H2O
x+y…….0,15-x
Dung dịch B tạo kết tủa với Ba(OH)2 nên HCO3- dư, vậy nCO2 = 0,15 – x = 0,045 —> x = 0,105
HCO3- + OH- + Ba2+ —> BaCO3 + H2O
—> nBaCO3 = (x + y) – (0,15 – x) = 0,15 —> y = 0,09
—> m = 20,13 gam
5) HCl+CaCO3------->CaCl2+H2O+CO2(1)
0,05
HCl + M2CO3 --------->MCl2 + H2O + CO2 (2)
4,787/(2M+60) 4,787/(2M+60)
nCaCo3=0,05(mol)
nM2CO3=4,787/(2M+60)(mol)
mCO2(1)=2,2(g)
Sau khi hai muối đã tan hoàn toàn, cân trở lại vị trí cân bằng nên ta có
mCaCO3 -mCO2(1)=mM2CO3 -mCO2(2)
5-2,2=4,787-210.628/(2M+60)
=>M=23
vậy M là Na
Câu 1 : Cho 3,36 lít SO2 hấp thụ hoàn toàn vào 200 ml dung dịch NaOH xM . Sau phản ứng, cô cạn dung dịch thu được 23 gam chất rắn khan. Tính x?
Câu 2 : Cho V lít khí S02 hấp thụ hoàn toàn vào 100 ml dung dịch NaOH 2M. Sau phản ứng , cô cạn dung dịch được m gam chất rắn khan. Tính V trong mỗi trường hợp sau :
a. m=12,6 gam
b.m=10,3 gam
c.m=20,4 gam
Hoà tan 2,4 gam Mg và 11,2 gam Fe vào 100 ml dung dịch CuSO 4 2M thì tách ra chất
rắn A và nhận được dung dịch B. Thêm NaOH dư vào dung dịch B rồi lọc kết tủa tách ra
nung đến lượng không đổi trong không khí thu được a gam chất rắn D. Viết phương trình
phản ứng, tính lượng chất rắn A và lượng chất rắn D. Biết, khi nung trong không khí đến
lượng không đổi có quá trình oxi hoá: Fe(OH) 2 + O 2 + H 2 O → Fe(OH) 3
(cho Ca = 40; Cu = 64; Fe = 56; Al = 27 ; Mg = 24; Ag = 108; O = 16)
Ta có: \(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{CuSO_4}=0,1.2=0,2\left(mol\right)\)
PT: \(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
____0,1_____0,1_____0,1_____0,1 (mol)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
0,1____0,1______0,1____0,1 (mol)
Chất rắn thu được gồm Cu và Fe dư.
Theo PT: nCu = 0,2 (mol)
nFe (dư) = 0,2 - 0,1 = 0,1 (mol)
⇒ m chất rắn = 0,2.64 + 0,1.56 = 18,4 (g)
PT: \(MgSO_4+2NaOH\rightarrow Mg\left(OH\right)_2+Na_2SO_4\)
\(Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
\(FeSO_4+2NaOH\rightarrow Fe\left(OH\right)_2+Na_2SO_4\)
\(4Fe\left(OH\right)_2+O_2\underrightarrow{t^o}2Fe_2O_3+4H_2O\)
Theo PT: \(n_{MgO}=n_{Mg}=0,1\left(mol\right)\), \(n_{Fe_2O_3}=\dfrac{1}{2}n_{Fe\left(pư\right)}=0,05\left(mol\right)\)
⇒ mD = mMgO + mFe2O3 = 0,1.40 + 0,05.160 = 12 (g)
Câu 1
Phải thêm bao nhiêu ml nước vào 100 ml dung dịch NaOH có pH là 13 để được dung dịch có pH = 12?
Câu 2
Cho 100 ml dung dịch NaOH 2M vào V lít dung dịch HNO3 có pH = 2 .Tính V để thu được dung dịch sau phản ứng có pH = 3
Câu3
cho 400 ml dung dịch NaOH vào 200ml dung dịch Al(NO3)31M thu được 7,8 gam kết tủa Tính nồng độ mol của dung dịch NaOH
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 21,9 gam hỗn hợp chất rắn gồm 2 kim loại. Giá trị của a là
A. 14,4
B. 21,6
C. 13,4
D. 10,8
Đáp án D
2 kim loại sau phản ứng là Cu và Al => Mg hết, CuSO4 hết, Al2(SO4)3 dư
=> nCu=nCuSO4=0,3 mol => mAl=21,9-0,3.64=2,7 gam =>nAl=0,1 mol
Mg + Cu2+ → Mg2+ + Cu
0,3 ← 0,3
3Mg + 2Al3+ → 3Mg2+ + 2Al
0,15 ← 0,1
=>mMg = 0,45.24 = 10,8 gam
Cho a gam Mg vào 100 ml dung dịch Al2(SO4)3 1M và CuSO4 3M thu được 21,9 gam hỗn hợp chất rắn gồm hai kim loại. Giá trị của a là
A. 14,4
B. 13,4
C. 10,8
D. 21,6
Đáp án C
hỗn hợp rắn gồm 2 kim loại → Al và Cu
Thứ tự phản ứng gồm :
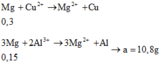
Có 4 dung dịch: X (Ba(AlO2)2 1M); Y (BaCl2 1M và NaAlO2 1M); Z (Ba(AlO2)2 1M và Ba(OH)2 1M); T (NaOH 1M và Ba(AlO2)2) 1M được kí hiệu ngẫu nhiên là (a), (b), (c), (d). Thực hiện các thí nghiệm sau:
- Thí nghiệm 1: Cho 100 ml dung dịch H2SO4 1M vào 100 ml dung dịch (a), thu được m1 gam kết tủa.
- Thí nghiệm 2: Cho 100 ml dung dịch H2SO4 1M vào 100 ml dung dịch (b), thu được m2 gam kết tủa.
- Thí nghiệm 3: Cho 100 ml dung dịch H2SO4 1M vào 100 ml dung dịch (c), thu được m3 gam kết tủa.
- Thí nghiệm 4: Cho 100 ml dung dịch H2SO4 1M vào 100 ml dung dịch (d), thu được m4 gam kết tủa.
Biết các phản ứng xảy ra hoàn toàn và m1< m2< m3< m4. Dung dịch (c) là
A. T.
B. Z.
C. X.
D. Y.
Có 4 dung dịch: X (Ba(AlO2)2 1M); Y (BaCl2 1M và NaAlO2 1M); Z (Ba(AlO2)2 1M và Ba(OH)2 1M); T (NaOH 1M và Ba(AlO2)2) 1M được kí hiệu ngẫu nhiên là (a), (b), (c), (d). Thực hiện các thí nghiệm sau:
- Thí nghiệm 1: Cho 100 ml dung dịch H2SO4 1M vào 100 ml dung dịch (a), thu được m1 gam kết tủa.
- Thí nghiệm 2: Cho 100 ml dung dịch H2SO4 1M vào 100 ml dung dịch (b), thu được m2 gam kết tủa.
- Thí nghiệm 3: Cho 100 ml dung dịch H2SO4 1M vào 100 ml dung dịch (c), thu được m3 gam kết tủa.
- Thí nghiệm 4: Cho 100 ml dung dịch H2SO4 1M vào 100 ml dung dịch (d), thu được m4 gam kết tủa.
Biết các phản ứng xảy ra hoàn toàn và m1< m2< m3< m4. Dung dịch (c) là
A. T.
B. Z.
C. X.
D. Y.
Câu 1: Tính số mol của các chất tan có trong dung dịch sau:
a. 200 ml dung dịch HCl 1M
b. 350 ml dung dịch NaOH 2M.
Câu 2: Tính C% của các dung dịch sau:
a. Hòa tan 98 gam H2SO4 vào 100 gam H2O.
Câu 3: Hòa tan hoàn toàn 16, 25 gam một kim loại hóa trị (II) bằng dung dịch HCl 18,25% ( D= 1,2g/ml), thu được dung dịch muối và 5,6 lít khí hiđro (đktc).
a. Xác định kim loại.
b. Xác định khối lương dung dịch HCl 18,25% đã dùng.
c. T ính CM của dung dịch HCl trên.
d. T ính nồng độ phần trăm của dung dịch muối sau phản ứng.
Câu 1: a. nHCl= 0,2*1= 0,2 (mol)
b. nNaOH= 0,35*2= 0,7 (mol)
Câu 2: mdd =98+100= 198(g)
C% dd=\(\dfrac{98\cdot100}{198}\approx49,5\%\)
Câu 3: gọi CTPT của kim loại hóa trị (II) là A
A + 2HCl --> ACl2 + H2;
a.ta có: nH2= \(\dfrac{5,6}{22,4}=0,25\left(mol\right)\);
=> nA= 0,25(mol);=> MA= \(\dfrac{16,25}{0,25}=65\)
vậy kim loại đó là kẽm (Zn).
b. nHCl= 0,25*2= 0,5 (mol)=> mHCl= 0,5*36,5= 18,25(g);
mdd HCl=\(\dfrac{18,25\cdot100}{18,25}=100\left(g\right)\)
c.Vdd HCl= 100/ 1,2= 83,3 (ml)= 0,083 (l)
=> Cm HCl= \(\dfrac{0,5}{0,083}=6,02\left(M\right)\)
d. ta có n ZnCl2= 0,25 (mol)=> m ZnCl2= 0,25*136= 34,9g)
mdd= 16,25+100- 0,25*2= 115,75 (g)
C% dd muối sau pư= \(\dfrac{34,9\cdot100}{115,75}=30,15\%\)