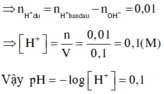Dung dịch X có chứa 0,07 mol Na + , 0,02 mol SO 4 2 - , và x mol OH - . Dung dịch Y có chứa ClO 4 - , NO 3 - và y mol H + ; tổng số mol ClO 4 - , NO 3 - là 0,04 mol. Trộn X và T được 100 ml dung dịch Z. Dung dịch Z có pH (bỏ qua sự điện li của H 2 O ) là :
A. 1.
B. 12.
C. 13.
D. 2.