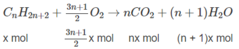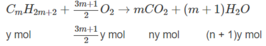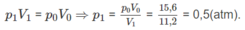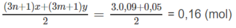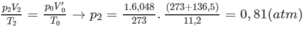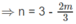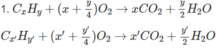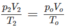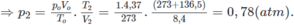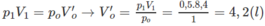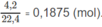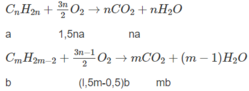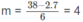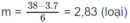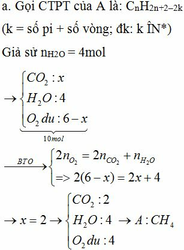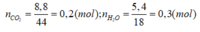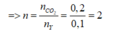Một bình kín dung tích 8,4 lít có chứa 4,96 g
O
2
và 1,3 gam hỗn hợp khí A gồm 2 hiđrocacbon. Nhiệt độ trong bình t1
0
°
C
và áp suất trong bình p1 0,5 atm.Bật tia lửa điện trong bình kín đó thì hỗn hợp A cháy hoàn toàn. Sau phản ứng, nhiệt độ trong bình là t2
136
,
5
°
C
và áp suất là p2 atm. Dẫn các chất trong bình sau phản ứng đi qua bình thứ nhất đựng
H...
Đọc tiếp
Một bình kín dung tích 8,4 lít có chứa 4,96 g
O
2
và 1,3 gam hỗn hợp khí A gồm 2 hiđrocacbon. Nhiệt độ trong bình t1 =
0
°
C
và áp suất trong bình p1 = 0,5 atm.
Bật tia lửa điện trong bình kín đó thì hỗn hợp A cháy hoàn toàn. Sau phản ứng, nhiệt độ trong bình là t2 =
136
,
5
°
C
và áp suất là p2 atm. Dẫn các chất trong bình sau phản ứng đi qua bình thứ nhất đựng
H
2
S
O
4
đặc, sau đó qua bình 2 đựng dung dịch NaOH (có dư) thì khối lượng bình thứ hai tăng 4,18 g.
1. Tính p2, biết rằng thể tích bình không đổi.
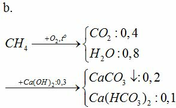
2. Xác định công thức phân tử và phần trăm theo thể tích của từng chất trong hỗn hợp A nếu biết thêm rằng trong hỗn hợp đó có một chất là anken và một chất là ankin.