Dd HCl và dd CH3COOH có cùng nồng độ mol/1, pH của hai dd tương ứng là x và y. Quan hệ giữa x và y là (giả thiết, cứ 100 phân tử CH3COOH thì có 1 phân tử điện li)
A. y = x - 2
B. y = 2x
C. y = 100x
D. y = x + 2
Dung dịch HCl và dung dịch CH3COOH có cùng nồng độ mol/lít. Giá trị pH tương ứng của dịch tương ứng là x và y. Quan hệ giữa x và y là ( giả thiết cứ 100 phân tử 2 dung CH3COOH thì có 1 phân tử điện li)
A. y = 100x
B. y = 2x
C. y = x-2
D. y = x+2
Đáp án D
HCl → H++ Cl-
[H+] = a M ; suy pH = -log a = x
![]()
Cứ 100 phân tử CH3COOH thì có 1 phân tử điện li nên [H+] = a/100 M suy ra pH = -log (a/100) = y
Do đó y-x = 2
Dung dịch HCl và CH3COOH có cùng nồng độ. pH của hai dung dịch này tương ứng là x và y. Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li. Quan hệ giữa x và y là:
A. y = 100x
B. y = 2x
C. y = x – 2
D. y = x + 2
Đáp án D
Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li
⇒ nH+/HCl = 100nH+/ CH3COOH
Mà dung dịch HCl và CH3COOH có cùng nồng độ
⇒ [H+/HCl] = 100[H+/ CH3COOH]
⇒ -log[H+/HCl] = -2 - log[H+/ CH3COOH]
⇒ x = -2 + y ⇒ y = x + 2
Đáp án D.
Cho 2 dung dịch HCl và CH3COOH có cùng nồng độ. Dung dịch HCl có pH = x, dung dịch CH3COOH có pH = y. Bỏ qua sự điện li của nước, các dung dịch ở cùng nhiệt độ phòng. Biết ở nhiệt độ phòng, cứ 100 phân tử CH3COOH thì có 1 phân tử phân li ra ion. Mối liên hệ của x và y là:
A. x = y - 2
B. y = x – 2
C. x = 2y
D. y = 2x
Không mất tính tổng quát, ta đặt:
![]()
Vì HCl là chất điện li mạnh nên ta có phương trình điện li như sau:
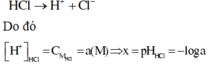
Vì CH3COOH là chất điện li yếu nên ta có phương trình điện li như sau
Xét cân bằng điện li: CH3COOH ⇌ CH3COO- + H+
Nồng độ ban đầu: aM 0
Nồng độ phân li: 0,01a M → 0,01a M
Nồng độ cân bằng: 0,99a M 0,01a M
Ta có
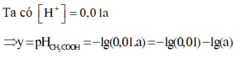
![]()
Đáp án A.
Dung dịch NaOH và dung dịch CH3COONa có cùng nồng độ mol/l. Giá trị pH của hai dung dịch tương ứng là x và y. Quan hệ giữa x và y là (giả sử cứ 100 ion CH3COO- thì có 1 ion thủy phân).
A. y = 100x
B. y = 2x
C. y = x+2
D. y = x-2
Chọn đáp án D
Đây là 2 dung dịch có môi trường bazo.NaOH có tính bazo mạnh hơn nên x >y.
Câu 1 :Dung dịch C tạo bởi dd A trộn với dd B theo tỉ lệ tương ứng là 1:2 . Tính PH của C
Câu 2 : Dd CH3COOH 1M tính nồng độ mol ion H+ trong dd đó . Biết cứ 100 phân tử CH3COOH có 1 phân tử phân li thành ion
Câu 3 : Hoà tan 3,66 g hỗn hợp Na, Ba vào nước dư thu đc 800ml dd A và 0,896l H2 . PH của A bằng bn ?
Dd X có chứa: 0,07 mol Na+; 0,02 mol SO42- và x mol OH- . Dd Y có chứa ClO4-, NO3- , và y mol H+; tổng số mol ClO4-và NO3- là 0,04. Trộn X và Y được 100 ml dd Z. Dd Z có pH (bỏ qua sự điện li của H2O) là
A. 1
B. 12
C. 13
D. 2.
Đáp án A
Bảo toàn điện tích:
n OH- = x = nNa+ - 2nSO42- = 0,07 – 0,02.2 = 0,03
n H+ = y = n ClO4- + n NO3- = 0,04 > n OH-
n H+ dư = 0,01 mol
⇒ [H+] = 0,01 : 0,1 = 0,1 ⇒ pH = -log10[H+] = 1
1......Cho 38.7 g oleum H2SO4.2SO3 vao 100 g dd H2SO4 30 phần trăm thu dc dd X . Nồng độ phần trăm của H2S04 trong X là
2......Hh X gồm metanol và etanol. Đốt cháy hết m g X , thu dc 0.672 l CO2 đktc và 0.9 g H2O. Đun nóng X vs H2SO4 140°C , khi p/ư xảy ra hoàn toàn thu dc m g este. Giá trị m là
3.....Dd X gồm Ba(OH)2 1M và Na(OH) 1 M . Dd Y gồm HCl 0.125 M và H2SO4 0.375. Trộn 100ml X vs 40ml Y , dc dd Z . Giá trị PH của Z là
4.....Điện phân 100 g dd X chứa 0.15 mol CuSO4 và a mol KCl ( điện cực trơ, màng ngăn xôp) đến khi nước bắt đầu bị điện phân ở 2 cực thì ngưng thu dc dd Y . Dd Y hòa tan tối đa 2.7 g Al . Giả sử hiệu suất điện phân là 100 phần trăm khí sinh ra k tan trong nước . Nồng độ phần trăm của K2SO4 trong Y là
5....Cho X Y lần lược là 2 axit cacboxylic mạch hở (Mx < My ) . Đốt cháy hoàn toàn a mol các hh gồm x mol X và y mol Y ( trong đó x:y của các hh đều khác nhau) , luôn thu dc 3a mol CO2 và 2a mol H2O . Phần trăm khối lượng của Oxi trong X và Y lần lượt là
6....dd X chưa các ion Na+ , Ba 2+ , HCO3 - , chia X thành 3 phần bằng nhau. Phần 1 t/d vs KOH dư, dx m g kết tủa . Phần 2 t/d vs Ba(OH)2 dư dc 4m g kết tủa . Đun sôi đế n cạn phần 3 thu dx V1 lít CO2 đktc và chất rắn Y đến khối lượng k đổi , thu dc V2 lít CO2 đktc . Tỉ lệ V1:V 2 là
7....dd X chưa các ion Na+ , Ba 2+ , HCO3 - , chia X thành 3 phần bằng nhau. Phần 1 t/d vs KOH dư, dx m g kết tủa . Phần 2 t/d vs Ba(OH)2 dư dc 4m g kết tủa . Đun sôi đế n cạn phần 3 thu dx V1 lít CO2 đktc và chất rắn Y đến khối lượng k đổi , thu dc V2 lít CO2 đktc . Tỉ lệ V1:V 2 là
8.....Hòa tan hoàn toàn 3.84 g Cu dd HNO3 dư thu dc hh X gồm NO2 và NO ( k còn sp khử khác) . Trộn X vs V lít O2 đktc thu dc hh khí Y . Cho Y t/d vs H2O , thu dc dd Z , còn lại 0.25 V lít O2 đktc .giá trị V là
9...Hh X gồm 2 chất hh đơn chức , đều có công thức phân tử C7H6O2 và chứa vòng benzen trog phan tử. Cho 3.66 g X p/ư vs lượng dư dd AgNO3 trog NH3 , thu dc 21.6 g Ag . Khối lượng muối thu dc khi cho cùng lượng X trên t/d hết vs dd KOH dư là
m.n...giúp..e...vs...ạ....e...cảm..ơn..rất..rất..rất...rất..nhìu..ạ,......
Cho X, Y, Z, T là các chất khác nhau trong số 4 chất: HCOOH; CH3COOH; HCl; C6H5OH (phenol) và pH của các dung dịch trên được ghi trong bảng sau:
| Chất |
X |
Y |
Z |
T |
| pH (dd cùng nồng độ, 250C) |
6,48 |
3,22 |
2,00 |
3,45 |
Nhận xét nào sau đây đúng?
A. Z tạo kết tủa trắng với dung dịch AgNO3
B. X được điều chế trực tiếp từ ancol etylic
C. Y tạo kết tủa trắng với nước brom
D. T cho được phản ứng tráng bạc
Đáp án : A
pH tăng dần : HCl ; HCOOH ; CH3COOH ; C6H5OH
trộn 300ml dd Hcl (dd x) với 500ml dd HCl (dd y) tạo thành dd Z. Cho dd Z tác dụng với 10,53g Zn vừa đủ.
a) Tính nồng độ mol dd Z
b) dd D được pha từ dd Y bằng cách pha thêm vào dd Y theo tỉ lệ Vh2o/Vy =2/1. tính nồng độ mol của dd X và dd Y