Đáp án D
HCl → H++ Cl-
[H+] = a M ; suy pH = -log a = x
![]()
Cứ 100 phân tử CH3COOH thì có 1 phân tử điện li nên [H+] = a/100 M suy ra pH = -log (a/100) = y
Do đó y-x = 2
Đáp án D
HCl → H++ Cl-
[H+] = a M ; suy pH = -log a = x
![]()
Cứ 100 phân tử CH3COOH thì có 1 phân tử điện li nên [H+] = a/100 M suy ra pH = -log (a/100) = y
Do đó y-x = 2
Dung dịch HCl và CH3COOH có cùng nồng độ. pH của hai dung dịch này tương ứng là x và y. Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li. Quan hệ giữa x và y là:
A. y = 100x
B. y = 2x
C. y = x – 2
D. y = x + 2
Cho 2 dung dịch HCl và CH3COOH có cùng nồng độ. Dung dịch HCl có pH = x, dung dịch CH3COOH có pH = y. Bỏ qua sự điện li của nước, các dung dịch ở cùng nhiệt độ phòng. Biết ở nhiệt độ phòng, cứ 100 phân tử CH3COOH thì có 1 phân tử phân li ra ion. Mối liên hệ của x và y là:
A. x = y - 2
B. y = x – 2
C. x = 2y
D. y = 2x
Dung dịch NaOH và dung dịch CH3COONa có cùng nồng độ mol/l. Giá trị pH của hai dung dịch tương ứng là x và y. Quan hệ giữa x và y là (giả sử cứ 100 ion CH3COO- thì có 1 ion thủy phân).
A. y = 100x
B. y = 2x
C. y = x+2
D. y = x-2
Điện phân dung dịch X chứa CuSO4 và NaCl (có tỷ lệ mol tương ứng là 1:3) với điện cực trơ, màng ngăn xốp bằng dòng điện một chiều có cường độ 1,34A, sau thời gian t giờ thu được dung dịch Y chứa hai chất tan và thấy khối lượng dung dịch Y giảm 10,375 gam so với khối lượng dung dịch X. Cho bột nhôm dư vào dung dịch Y, sau khi các phản ứng xảy ra hoàn toàn thu được 1,68 lít khí H2 (đktc). Giả sử khí sinh ra trong quá trình điện phân thoát ra hết khỏi dung dịch. Giá trị của t gần nhất với giá trị nào sau đây ?
A. 4,0
B. 7,0
C. 6,0
D. 5,0
Hai chất X và Y cùng có công thức phân tử C9H8O2, cùng là dẫn xuất của bezen, đều làm mất màu nước Br2. X tác dụng với dung dịch NaOH cho 1 muối và 1 anđehit, Y tác dụng với dung dịch NaOH cho 2 muối và nước. Các muối sinh ra đều có phân tử khối lớn hơn phân tử khối của CH3COONa. X và Y tương ứng là:
A. HCOOC2H2C6H5, HCOOC6H4C2H3
B. C6H5COOC2H3, C2H3COOC6H5
C. C2H3COOC6H5, HCOOC6H4C2H3
D. C6H5COOC2H3, HCOOC6H4C2H3
Dung dịch axit mạnh một nấc X nồng độ 0,010 mol/l có pH = 2 và dung dịch bazơ mạnh một nấc Y nồng độ 0,010 mol/l có pH = 12. Vậy:
A. X và Y là các chất điện li mạnh.
B. X và Y là các chất điện li yếu.
C. X là chất điện li mạnh, Y là chất điện li yếu.
D. X là chất điện li yếu, Y là chất điện li mạnh.
Hòa tan hết 8,56 gam hỗn hợp X gồm Fe3O4 và CuO (tỉ lệ mol tương ứng là 3 :2) trong lượng vừa đủ dung dịch HCl, thu được dung dịch Y. điện phân dung dịch Y (điện cực trơ màng ngăn xốp, hiệu suất đạt 100%) với cường độ dòng điện không đổi 5A, đến khi khối lượng dung dịch giảm 11,18 gam thì dừng điện phân và thu được dung dịch Z. Dung dịch Z tác dụng vừa đủ với V ml dung dịch KMnO4 0,1M trong dung dịch H2SO4 loãng. Giá trị của V là :
A. 240
B. 80
C. 160
D. 400
Nhỏ từ từ V lít dung dịch chứa Ba(OH)2 0,5M vào dung dịch chứa x mol NaHCO3 và y mol BaCl2. Đồ thị sau đây biểu diễn sự phụ thuộc giữa số mol kết tủa và thể tích dung dịch Ba(OH)2.
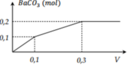
Giá trị x,y tương ứng là
A. 0,4 và 0,05.
B. 0,2 và 0,05.
C. 0,2 và 0,10.
D. 0,1 và 0,05.
Điện phân 1 lít dung dịch X gồm Cu(NO3)2 0,6M và FeCl3 0,4M đến khi anot thoát ra 17,92 lít khí (đktc) thì dừng lại. Lấy catot ra khỏi bình điện phân, khuấy đều dung dịch để phản ứng xảy ra hoàn toàn thì thu được dung dịch Y. Giả thiết kim loại sinh ra đều bám lên catot, sản phẩm khử của N+5 (nếu có) là NO duy nhất, hiệu suất điện phân là 100%. Hiệu khối lượng dung dịch X và Y gần nhất là
A. 91 gam.
B. 102 gam.
C. 101 gam.
D. 92 gam.