Hấp thụ hoàn toàn m gam SO3 vào 180 gam dung dịch H2SO4 98%, thu được oleum có công thức H2SO4.3SO3. Xác định giá trị m.
H2SO4 nguyên chất có khả năng hấp thụ SO3 tạo oleum theo phương trình sau:
H2SO4 + nSO3 → H2SO4.nSO3 (oleum)
Hòa tan 50,7 gam oleum có công thức H2SO4.nSO3 vào nước, thu được 98 gam dung dịch H2SO4 60%. Xác định giá trị n.
H2SO4 nguyên chất có khả năng hấp thụ SO3 tạo oleum theo phương trình sau:
H2SO4 + nSO3 → H2SO4.nSO3 (oleum)
axit H2SO4 100% hấp thụ SO3 tạo ra oleum theo phương trình H2SO4 + SO3 -> H2SO4.nSO3 . Hòa tan 6,76 gam gam oleum vào nước thành 200 ml dung dịch H2SO4 . 10 ml dung dịch trung hòa vừa hết 16 ml dung dịch NaOH 0,5 M a- tính n b- tính hàm lượng % SO3 trong oleum c- cần có bao nhiêu gam oleum có hàm lượng SO3 như trên để pha vào 100 ml dung dịch H2SO4 40% , d= 1,31 g/ml để tạo ra oleum có hàm lượng SO3 là 10%.
H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé
Hấp thụ m gam SO3 vào 100 gam dung dịch H2SO4 96,4% thu được một loại oleum có phần tram khối lượng SO3 là 40,82%. Giá trị của m là:
A. 104
B. 80
C. 96
D. 98
Hấp thụ m gam SO3 vào 100 gam dung dịch H2SO4 96,4% thu được một loại oleum có phần tram khối lượng SO3 là 40,82%. Giá trị của m là:
A. 104
B. 80
C. 96
D. 98
Hấp thụ m gam SO3 vào 100 gam dung dịch H2SO4 96,4% thu được 1 loại oleum có phần trăm khối lượng SO3 là 40,82%. Giá trị của m là:
A. 104.
B. 80.
C. 96.
D. 98.
Axit sunfuric H2SO4 là một trong những hóa chất có ứng dụng hàng đầu trong đời sống như: sản xuất phân bón, thuốc trừ sâu, chất giặt rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn, dược phẩm. Trên thế giới mỗi năm người ta sản xuất khoảng 160 triệu tấn H2SO4 từ lưu huỳnh hoặc quặng pirit FeS2 theo sơ đồ sau:
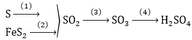
a. Hoàn thành sơ đồ chuyển hóa trên (ghi rõ điều kiện phản ứng nếu có)
b. Trong thực tế sản xuất, để an toàn người ta không hấp thụ trực tiếp SO3 vào nước mà hấp thụ SO2 vào H2SO4 đặc để tạothành Oleum (H2SO4.nSO3). Tùy theo mục đích sử dụng người ta hòa tan Oleum vào nước để thu được dung dịch H2SO4 có nồng độ theo yêu cầu. Hòa tan hoàn toàn 16,9 gam Oleum vào nước thu được 25 gam dung dịch H2SO4 78,4%. Xác định công thức của Oleum.
hấp thụ m gam oleum có công thức H2SO4.SO3 vào 100 gam dung dịch H2SO4 96,4% thu được một loại oleum có phần trăm khối lượng SO3 là 5,22% .giá trị của m là
Gọi nSO3 trong oleum ban đầu là x (mol)
mH20 trong dung dịch H2SO4 96,4% là : \(\frac{100.\left(100-96,4\right)}{100}=3,6\) (g)
nH20 ................................................... là : \(\frac{3,6}{18}=0,2\) (mol)
Ta có : H20 + SO3 -> H2SO4
0,2 -> 0,2 -> 0,2 (mol)
mSO3 sau khi hấp thụ là : (x - 0,2).80 (g)
m oleum sau khi hấp thụ là : 100 + (98 + 80)x = 100 + 178x (g)
%SO3 = \(\frac{\left(x-0,2\right)80}{100+178x}=\frac{5,22}{100}\)
=> x = 0,3 (mol)
Giá trị của m là : 0,3.(98+80) = 53,4 (g)
\(m_{dd\ H_2SO_4} = D.V = 1,31.100 = 131(gam)\\ \Rightarrow m_{H_2SO_4} = 131.40\% = 52,4(gam)\\ \Rightarrow m_{H_2O} = 131-52,4 = 78,6\ gam\\ \Rightarrow n_{H_2O} = \dfrac{78,6}{18}=\dfrac{131}{30}(mol)\\ n_{oleum} = x(mol) \Rightarrow n_{SO_3} = 3x(mol)\\ SO_3 + H_2O\to H_2SO_4\\ n_{SO_3\ pư} = n_{H_2O} = \dfrac{131}{30}\ mol\\ n_{SO_3\ dư} = 3x - \dfrac{131}{30}\ mol\\ m_{oleum} = 131 + 338x(gam)\\ \)
\(\eqalign{ & \% {m_{S{O_3}}} = {{\left( {3x - {{131} \over {30}}} \right).80} \over {131 + 338x}}.100\% = 10\% \cr & \Rightarrow x = 1,7577 \cr & \Rightarrow {m_{{H_2}S{O_4}.3S{O_3}}} = 338.1,7577 = 594(g) \cr}\)
Oleum X có công thức H2SO4.aSO3, trong đó So3 chiếm 71% về khối lượng .
a. Xác định a
b. Cần bao nhiêu gam oleum cho vào 147g dd H2SO4 40% để thu được oleum Y, trong đó So3 chiếm 10% về khối lượng
Ta có công thức tổng quát của Oleum là H2SO4.nSO3
SO3 chiếm 71% về khối lượng
⇒ (80n/98 + 80n).100% = 71%
⇔ (80n/98 + 80n) = 0,71
⇒ 80n = 0,71.(98+80n)
⇔ 23,2n = 69,58
⇔ n = 3
⇒ CTHH của Oleum X là H2SO4.3SO3