Bản chất của liên kết ion là lực hút tĩnh điện giữa
A. 2 ion.
B. các ion mang điện trái dấu.
C. các hạt mang điện trái dấu.
D. hạt nhân và các electron hóa trị.
Cho các phát biểu sau:
1. Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
2. Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số notron khác nhau về số electron
3. Các electron trên cùng một phân lớp khác nhau về mức năng lượng
4. Phân lớp p chứa tối đa 6 electron
5. Các electron trên cùng một lớp có mức năng lượng bằng nhau
6. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu
Số phát biểu đúng là
A. 4
B. 3
C. 1
D. 2
Đáp án A
Các trường hợp thỏa mãn: 1-4-5-6
Cho các phát biểu sau:
1. Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
2. Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số notron khác nhau về số electron
3. Các electron trên cùng một phân lớp khác nhau về mức năng lượng
4. Phân lớp p chứa tối đa 6 electron
5. Các electron trên cùng một lớp có mức năng lượng bằng nhau
6. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu
Số phát biểu đúng là
A. 4
B. 3
C. 1
D. 2
Các trường hợp thỏa mãn: 1-4-5-6
ĐÁP ÁN A
Cho các phát biểu sau :
1. Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
2. Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số notron khác nhau về số electron
3. Các electron trên cùng một phân lớp khác nhau về mức năng lượng
4. Phân lớp p chứa tối đa 6 electron
5. Các electrong trên cùng một lớp có mức năng lượng gần bằng nhau
6. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái đấu
Số phát biểu đúng là :
A. 4.
B. 3.
C. 1.
D. 2.
Đáp án A
1. Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
4. Phân lớp p chứa tối đa 6 electron
5. Các electrong trên cùng một lớp có mức năng lượng gần bằng nhau
6. Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái đấu
Câu 1: Hợp chất nào sau đây có liên kết ion?
A. KCl.
B. HCl.
C. NH3.
D. H2O.
Câu 2: Hợp chất nào sau đây có liên kết ion?
A. HCl.
B. H2.
C. MgO.
D. H2O.
Câu 3: Liên kết hóa học được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu gọi là
A. liên kết cộng hóa trị có cực.
B. liên kết kim loại.
C. liên kết cộng hóa trị không cực.
D. liên kết ion.
Câu 4: Liên kết ion tạo thành giữa hai nguyên tử
A. kim loại điển hình.
B. phi kim điển hình.
C. kim loại và phi kim.
D. kim loại điển hình và phi kim điển hình.
Câu 5: Chỉ ra nội dung sai khi nói về ion:
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Câu 6: Nguyên tử của nguyên tố clo có 7 electron ở lớp ngoài cùng, khi tham gia liên kết với các nguyên tố khác, oxi có xu hướng:
A. nhận thêm 1 electron.
B. nhường đi 2 electron.
C. nhận thêm 2 electron.
D. nhường đi 6 electron.
Câu 7: Phân tử KCl được hình thành do
A. sự kết hợp giữa hai nguyên tử K và Cl.
B. sự kết hợp giữa hai ion K+ và Cl2-.
C. sự kết hợp giữa hai ion K- và Cl+.
D. sự kết hợp giữa hai ion K+ và Cl-.
Câu 8: Nhóm hợp chất nào sau đây đều là hợp chất ion?
A. H2S, Na2O.
B. CH4, CO2.
C. CaO, NaCl.
D. SO2, KCl.
Câu 9: Hợp chất nào sau đây có chứa liên kết ion trong phân tử:
A. Na2O; KCl; HCl.
B. K2O; BaCl2; CaF.
C. Na2O; H2S; NaCl.
D. CO2; K2O; CaO.
Câu 10: Có 2 nguyên tố X (Z = 19); Y (X = 17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là:
A. XY, liên kết ion.
B. X2Y, liên kết ion.
C. XY, liên kết cộng hóa trị có cực.
D. XY2, liên kết cộng hóa trị có cực.
....
Câu 11: Hợp chất nào sau đây có liên kết cộng hóa trị?
A. HCl.
B. MgO.
C. NaCl.
D. K2O.
Câu 12: Chất nào sau đây có liên cộng hóa trị không phân cực?
A. HCl.
B. NH3.
C. Cl2.
D. H2O.
Câu 13: Chất nào sau đây có liên cộng hóa trị phân cực?
A. O2.
B. NH3.
C. Cl2.
D. H2.
Câu 14: Trong phân tử sẽ có liên kết cộng hoá trị không phân cực nếu cặp electron chung
A. ở giữa hai nguyên tử.
B. lệch về một phía một nguyên tử.
C. chuyển hẳn về một nguyên tử.
D. nhường hẳn về một nguyên tử.
Câu 15: Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
A. ở giữa hai nguyên tử.
B. lệch về một phía một nguyên tử.
C. chuyển hẳn về một nguyên tử.
D. nhường hẳn về một nguyên tử.
Câu 16: Liên kết cộng hóa trị không phân cực thường là liên kết giữa:
A. Hai kim loại giống nhau.
B. Hai phi kim giống nhau.
C. Một kim loại mạnh và một phi kim mạnh.
D. Một kim loại yếu và một phi kim yếu.
Câu 17: Tùy thuộc vào số cặp electron dùng chung tham gia tạo thành liên kết cộng hóa trị giữa 2 nguyên tử mà liên kết được gọi là:
A. liên kết phân cực, liên kết lưỡng cực, liên kết ba cực.
B. liên kết đơn giản, liên kết phức tạp.
C. liên kết đơn, liên kết đôi, liên kết ba.
D. liên kết xích ma, liên kết pi, liên kết đelta.
Câu 18: Liên kết cộng hóa trị là liên kết giữa 2 nguyên tử
A. phi kim, được tạo thành do sự góp chung electron.
B. khác nhau, được tạo thành do sự góp chung electron.
C. được tạo thành do sự góp chung một hay nhiều electron.
D. được tạo thành từ sự cho nhận electron giữa chúng.
....
Câu 19: Điện tích quy ước của các nguyên tử trong phân tử, nếu coi phân tử có liên kết ion được gọi là
A. điện tích nguyên tử.
B. số oxi hóa.
C. điện tích ion.
D. cation hay anion.
Câu 20: Số oxi hóa của S trong phân tử H2SO4 là
A. +4.
B. +6.
C. -4.
D. -6.
Câu 21: Số oxi hóa của Mn trong phân tử KMnO4 là
A. +6.
B. +7.
C. -6.
D. -7.
Câu 11: Số oxi hóa của Cl trong phân tử NaClO3 là
A. +5.
B. +7.
C. -5.
D. -7.
Câu 22: Số oxi hóa của Cr trong phân tử K2Cr2O7 là
A. -6.
B. -3.
C. +3.
D. +6.
Câu 23: Số oxi hóa của N trong ion là
A. +3.
B. -5.
C. +5.
D. -3.
Câu 24: Số oxi hóa của C trong ion là
A. -6.
B. -4.
C. +6.
D. +4.
Câu 25: Số oxi hóa của Cl trong các hợp chất KCl, KClO, KClO2; KClO3, KClO4 lần lượt là
A. -1; +3; +1; +5; +7.
B. -1; +1; +3; +5; +7.
C. -1; +5; +3; +1; +7.
D. -1; +1; +3; +7; +5.
Câu 26: Cho 0,83 gam hỗn hợp gồm Al và Fe tác dụng với dung dịch H2SO4 loãng dư. Sau phản ứng thu được 0,56 lít khí H2 (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp lần lượt là:
A. 32,53% và 67,47%.
B. 67,5% và 32,5%.
C. 55% và 45%.
D. 45% và 55%.
.....
Câu 27: Hãy cho biết là quá trình nào sau đây?
A. Oxi hóa.
B. Khử.
C. Nhận proton.
D. Tự oxi hóa – khử.
Câu 28: Hãy cho biết là quá trình nào sau đây?
A. Oxi hóa.
B. Khử.
C. Nhận proton.
D. Tự oxi hóa – khử.
Câu 29: Chất khử trong phản ứng là
A. Mg.
B. HCl.
C. MgCl2.
D. H2.
Câu 30: Chất oxi hóa trong phản ứng là
A. Ag.
B. AgNO3.
C. Cu.
D. Cu(NO3)2.
Câu 31: Chất bị oxi hóa trong phản ứng là
A. Na.
B. H2O.
C. NaOH.
D. H2.
Câu 32: Chất bị khử trong phản ứng là
A. Cu.
B. H2SO4.
C. CuSO4.
D. SO2.
Câu 33: Vai trò của H2S trong phản ứng 2FeCl3 + H2S 2FeCl2 + S + 2HCl là
A. chất oxi hóa.
B. chất khử.
C. axit.
D. axit và chất khử.
Câu 34: Trong phản ứng nào dưới đây cacbon thể hiện đồng thời tính oxi hoá và tính khử?
A. B.
C. D.
Câu 35: Vài trò của HCl trong phản ứng MnO2 + 4HCl MnCl2 + Cl2 + 2H2O là
A. oxi hóa.
B. chất khử.
C. tạo môi trường.
D. chất khử và môi trường.
Câu 36: Cho phương trình hoá học: Hệ số nguyên và tối giản của chất oxi hoá là
A. 2.
B. 4.
C. 1.
D. 3.
Câu 37: Cho phương trình hoá học: Tỉ lệ a : b là
A. 1 : 3.
B. 1 : 2.
C. 2 : 3.
D. 2 : 9.
Câu 38: Cho phương trình phản ứng sau: Nếu hệ số của HNO3 là 8 thì tổng hệ số của Zn và NO là:
A. 4.
B. 3.
C. 6.
D. 5.
Câu 39: Hòa tan hoàn toàn 7,8 gam hỗn hợp gồm Al và Mg trong dung dịch HCl (dư), thu được 8,96 lít khí H2 (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 22,4.
B. 28,4.
C. 36,2.
D. 22,0.
Câu 40: Hoà tan 7,8 gam hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau phản ứng khối lượng dung dịch axit tăng thêm 7,0 gam. Khối lượng nhôm và magie trong hỗn hợp đầu là
A. 2,7 gam và 1,2 gam.
B. 5,4 gam và 2,4 gam.
C. 5,8 gam và 3,6 gam.
D. 1,2 gam và 2,4 gam.
Câu 1: Hợp chất nào sau đây có liên kết ion?
A. KCl.
B. HCl.
C. NH3.
D. H2O.
Câu 2: Hợp chất nào sau đây có liên kết ion?
A. HCl.
B. H2.
C. MgO.
D. H2O.
Câu 3: Liên kết hóa học được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu gọi là
A. liên kết cộng hóa trị có cực.
B. liên kết kim loại.
C. liên kết cộng hóa trị không cực.
D. liên kết ion.
Câu 4: Liên kết ion tạo thành giữa hai nguyên tử
A. kim loại điển hình.
B. phi kim điển hình.
C. kim loại và phi kim.
D. kim loại điển hình và phi kim điển hình.
Câu 5: Chỉ ra nội dung sai khi nói về ion:
A. Ion là phần tử mang điện.
B. Ion âm gọi là cation, ion dương gọi là anion.
C. Ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử.
D. Ion được hình thành khi nguyên tử nhường hay nhận electron.
Câu 6: Nguyên tử của nguyên tố clo có 7 electron ở lớp ngoài cùng, khi tham gia liên kết với các nguyên tố khác, oxi có xu hướng:
A. nhận thêm 1 electron.
B. nhường đi 2 electron.
C. nhận thêm 2 electron.
D. nhường đi 6 electron.
Câu 7: Phân tử KCl được hình thành do
A. sự kết hợp giữa hai nguyên tử K và Cl.
B. sự kết hợp giữa hai ion K+ và Cl2-.
C. sự kết hợp giữa hai ion K- và Cl+.
D. sự kết hợp giữa hai ion K+ và Cl-.
Câu 8: Nhóm hợp chất nào sau đây đều là hợp chất ion?
A. H2S, Na2O.
B. CH4, CO2.
C. CaO, NaCl.
D. SO2, KCl.
Câu 9: Hợp chất nào sau đây có chứa liên kết ion trong phân tử:
A. Na2O; KCl; HCl.
B. K2O; BaCl2; CaF.
C. Na2O; H2S; NaCl.
D. CO2; K2O; CaO.
Câu 10: Có 2 nguyên tố X (Z = 19); Y (X = 17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là:
A. XY, liên kết ion.
B. X2Y, liên kết ion.
C. XY, liên kết cộng hóa trị có cực.
D. XY2, liên kết cộng hóa trị có cực.
....
Hợp chất ion G tạo nên từ các ion đơn nguyên tử M 2 + và X 2 - . Tổng số hạt (nơtron, proton, electron) trong phân tử G là 84, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28 hạt. Số hạt mang điện của ion X 2 - ít hơn số hạt mang điện của ion M 2 + là 20 hạt. Vị trí của M trong bảng tuần hoàn là
A. ô 8, chu kì 2, nhóm VIA
B. ô 20, chu kì 4, nhóm IIA
C. ô 26, chu kì 4, nhóm VIIIB
D. ô 12, chu kì 3, nhóm IIA
Hợp chất ion G tạo nên từ các ion đơn nguyên tử M2+ và X2-. Tổng số hạt (nơtron, proton, electron) trong phân tử G là 84, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28 hạt. Số hạt mang điện của ion X2- ít hơn số hạt mang điện của ion M2+ là 20 hạt. Vị trí của M trong bảng tuần hoàn là
A. ô 8, chu kì 2, nhóm VIA.
B. ô 20, chu kì 4, nhóm IIA.
C. ô 26, chu kì 4, nhóm VIIIB.
D. ô 12, chu kì 3, nhóm IIA.
Đáp án B
Gọi a, b là lần lượt tổng số proton và nơtron
Ta có: 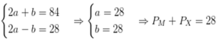
Ta có:
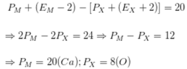
M là canxi ở ô 20, chu kì 4, nhóm IIA
Chọn B
Liên kết hóa học trong NaCl được hình thành là do.
A. Hai hạt nhân nguyên tử hút electron rất mạnh.
B. Mỗi nguyên tử Na và Cl góp chung 1 electron.
C. Mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau.
D. Na → Na+ e ; Cl + e → Cl- ; Na+ + Cl- → NaCl.
Chọn đáp án đúng nhất
vì sao như ta đã biết 2 hạt mang điện trái dấu thì hút nhanh nma sao trong nguyên tử thì hạt nhân có điện dương lại ko hút các electron v
Electron hay điện tử,[9] là một hạt hạ nguyên tử, có ký hiệu là e⁻
hay β⁻
, mà điện tích của nó bằng trừ một điện tích cơ bản.[10] Các electron thuộc về thế hệ thứ nhất trong họ các hạt lepton,[11] và nói chung được coi là những hạt cơ bản bởi vì chúng không có các thành phần nhỏ hay cấu trúc con.[1] Electron có khối lượng xấp xỉ bằng 1/1836 so với của proton.[12] Các tính chất cơ học lượng tử của electron bao gồm giá trị mômen động lượng (spin) bằng một nửa đơn vị, biểu diễn theo đơn vị của hằng số Planck thu gọn, ħ. Vì là một fermion, trong hệ cô lập không có hai electron nào có thể ở cùng một trạng thái lượng tử, như nội dung của nguyên lý loại trừ Pauli.[11] Giống như tất cả các hạt cơ bản khác, electron thể hiện cả các tính chất của sóng và hạt: chúng có thể va chạm với các hạt khác và bị nhiễu xạ như ánh sáng. Các tính chất sóng của electron dễ dàng được quan sát thấy ở các thí nghiệm hơn so với những hạt khác ví dụ như neutron và proton bởi vì electron có khối lượng nhỏ hơn và do vậy có bước sóng de Broglie dài hơn ở cùng một mức năng lượng.
Electron có vai trò cơ bản ở nhiều hiện tượng vật lý, như điện, từ học, hóa học và độ dẫn nhiệt. Ngoài ra nó cũng tham gia vào tương tác hấp dẫn, điện từ và yếu.[13] Vì một electron mang điện tích, bao xung quanh nó là điện trường, và nếu electron chuyển động tương đối với một người quan sát, nó sẽ cảm ứng một từ trường. Trường điện từ tạo ra bởi những nguồn khác sẽ ảnh hưởng đến chuyển động của hạt electron tuân theo định luật lực Lorentz. Electron phát ra hay hấp thụ năng lượng dưới dạng các photon khi chúng chuyển động gia tốc. Các thiết bị ở phòng thí nghiệm có khả năng bẫy từng electron đơn lẻ cũng như các electron plasma bằng sử dụng điện từ trường. Những kính thiên văn đặc biệt có thể phát hiện electron plasma trong không gian vũ trụ. Electron tham dự vào nhiều ứng dụng thực tiễn như điện tử học, hàn tia điện tử, ống tia âm cực, kính hiển vi điện tử, trị liệu bức xạ, laser electron tự do, máy dò khí ion hóa và máy gia tốc hạt.
Các tương tác có sự tham gia của những electron với các hạt khác là một trong những chủ đề nghiên cứu của hóa học và vật lý hạt nhân. Tương tác lực Coulomb giữa các proton mang điện dương bên trong hạt nhân nguyên tử và các electron mang điện âm ở orbital cấu thành lên nguyên tử. Sự ion hóa hay sự chênh lệch giữa số electron mang điện âm và hạt nhân mang điện dương làm thay đổi năng lượng liên kết của một hệ nguyên tử. Sự trao đổi hay chia sẻ các electron giữa hai hay nhiều nguyên tử là nguyên nhân chủ yếu tạo ra liên kết hóa học.[14] Năm 1838, nhà triết học tự nhiên người Anh Richard Laming lần đầu tiên đã đặt ra khái niệm về một đại lượng điện tích không thể chia nhỏ hơn nhằm giải thích các tính chất hóa học của các nguyên tử.[3] Nhà vật lý người Ireland George Johnstone Stoney sau đó đặt tên đại lượng điện tích này là 'electron' vào năm 1891, và sau đó J. J. Thomson cùng các cộng sự người Anh cuối cùng đã phát hiện ra electron có biểu hiện của một hạt cơ bản vào năm 1897.[5] Electron cũng tham gia vào các phản ứng hạt nhân, như quá trình tổng hợp lên các hạt nhân nặng hơn trong các sao, mà chúng thường được gọi là các hạt beta. Electron cũng có thể được tạo ra trong phân rã beta từ các đồng vị phóng xạ và trong các va chạm năng lượng cao, như ở sự kiện các tia vũ trụ bắn phá bầu khí quyển. Phản hạt của electron được gọi là positron; nó có tính chất đồng nhất với electron ngoại trừ các tích như điện tích mang dấu ngược lại. Khi một electron va chạm với một positron, cả hai hạt bị hủy, tạo ra hai photon tia gamma năng lượng cao.
Tham khảo