Cho 500 ml dung dịch hỗn hợp gồm H N O 3 0,2M và HCl 1M. Khi cho Cu tác dụng với dung dịch thì chỉ thu được một sản phẩm duy nhất là NO. Khối lượng Cu có thể hoà tan tối đa vào dung dịch là :
A. 3,2 gam.
B. 6,4 gam.
C. 2,4 gam.
D. 9,6 gam.
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H 2 S O 4 0,5M và N a N O 3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất của N + 5 Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là
A. 240
B. 120
C. 360
D. 400
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là
A. 400 ml.
B. 120 ml.
C. 240ml.
D. 360ml.
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H 2 S O 4 0,5M và N a N O 3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360 ml
B. 240 ml
C. 400 ml
D. 120 ml
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360 ml
B. 240 ml
C. 400 ml
D. 120 ml
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là :
A. 120
B. 240.
C. 360
D. 400.
Đáp án C
Bản chất phản ứng của Fe, Cu với dung dịch hỗn hợp H2SO4, NaNO3 là phản ứng oxi hóa – khử. Xét toàn bộ quá trình phản ứng, ta thấy dung dịch cuối cùng chỉ chứa Na+, SO 4 2 - và NO 3 - .
Dựa vào giả thiết và áp dụng bảo toàn electron, bảo toàn điện tích cho dung dịch sau cùng, ta có :
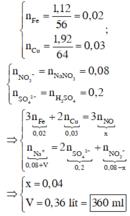
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H 2 S O 4 0,5M và N a N O 3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất của N 5 + Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là
A. 240.
B. 120
C. 360
D. 400
Đáp án C
Ta có ![]()
![]()
![]()
![]()
![]()
kim loại phản ứng hết
Dung dịch X chứa
H
+
: ![]()
![]()
Để lượng kết tủa lớn nhất gồm ![]()
![]()
![]()
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X và khí NO (sản phẩm khử duy nhất, ở đktc). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là
A. 240.
B. 400.
C. 360.
D. 120.
Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360
B. 240
C. 400
D. 120
Ta có: nFe=0,02 mol; nCu= 0,03 mol, nH2SO4= 0,2 mol, nNaNO3= 0,08 mol
nH+= 2n H 2 S O 4 = 0,4 mol, n N O 3 -= 0,08 mol
3Cu + 8H+ + 2NO3-® 3Cu2+ + 2NO + 4H2O (1)
0,03 0,08 0,02 ® 0,03 mol
Fe + 4H+ + NO3- ® Fe3+ + NO + 2H2O (2)
0,02 0,08 0,02 ® 0,02 mol
Tổng số mol H+ tham gia phản ứng (1) và (2) là 0,08+ 0,08= 0,16 mol
→nH+ dư= 0,4-0,16= 0,24 mol
Dung dịch X có chứa Cu2+, Fe3+ và H+
H++ OH-→H2O (3)
Cu2++ 2OH- → Cu(OH)2 (4)
Fe3++ 3OH- → Fe(OH)3 (5)
Theo PT (3), (4), (5) ta có
nOH-= nH++ 2nCu2++ 3nFe3+= 0,24+ 2.0,03+ 3.0,02= 0,36 mol= nNaOH
→V= 0,36 lít= 360 ml
Đáp án A
Cho 9,6g Cu tác dụng với 180 ml dung dịch HNO3 1M thu được V1 lit khí NO duy nhất và dung dịch A. Mặt khác cũng cho lượng Cu như trên tác dụng với 180 ml dung dịch hỗn hợp gồm HNO3 1M và H2SO4 0,5M thì được V2 lit NO duy nhất và dung dịch B.
b) Cô cạn dung dịch B rồi nung nóng đến khối lượng không đổi được m(g) chất rắn. Tính m
c) Oxi hóa V1 lit NO bằng O2 rồi dẫn sản phẩm vào 200ml nước có hòa tan 0,72g khí O2. Tính pH dung dịch sau phản ứng (coi thể tích dung dịch không đổi)
\(n_{Cu}=\dfrac{9,6}{64}=0,15\left(mol\right)\)
\(n_{HNO_3}=0,18\left(mol\right)\)
\(+TH_1:\)
Vì thu được \(NO\) duy nhất → Có 2 trường hợp xảy ra, hoặc là `Cu` hết hoặc là `HNO_3` hết
\(\left[e\right]:2.0,15=3.n_{NO}\Leftrightarrow n_{NO}=0,1\left(mol\right)\)
Mặt khác ta có: \(n_{H^+}=4n_{NO}=0,18\Leftrightarrow n_{NO}=0,045\left(mol\right)\)
→ Chứng tỏ `Cu` dư
\(NO\left(0,045\right)\underrightarrow{+O_2}NO_2\rightarrow HNO_3\)
\(PTHH:NO_2+\dfrac{1}{2}O_2+H_2O\rightarrow2HNO_3\)
\(\left(mol\right)\) \(0,045\) \(0,0225\)
→ Tính theo oxi
\(\Rightarrow n_{HNO_3}=0,0225.2.2=0,09\left(mol\right)\\
\Rightarrow\left[H^+\right]=\dfrac{0,09}{0,2}=0,45\left(M\right)\\
\Rightarrow pH=-log\left(H^+\right)\approx0,35\)
\(+TH_2:\) Tóm tắt các phản ứng như sau
\(0,15\left(mol\right)Cu+\left\{{}\begin{matrix}H_2SO_4:0,09\left(mol\right)\\HNO_3:0,18\left(mol\right)\end{matrix}\right.\rightarrow V\left(l\right)NO+B\left\{{}\begin{matrix}Cu\left(NO_3\right)_2:0,135\\SO_4^{2-}:0,09\end{matrix}\right.+Cu:0,015\left(mol\right)\)
Tương tự như trường hợp 1 ta có:
\(n_{H^+}=4n_{NO}\Leftrightarrow0,36=4n_{NO}\Leftrightarrow n_{NO}=0,09\left(mol\right)\) và \(Cu\) dư \(0,015\left(mol\right)\)
\(\left\{{}\begin{matrix}0,045\left(mol\right)Cu\left(NO_3\right)_2\\0,09\left(mol\right)CuSO_4\end{matrix}\right.+Cu\left(0,015\right)\underrightarrow{t^o}\left\{{}\begin{matrix}CuO:0,045\\CuSO_4:0,09\\Cu:0,015\end{matrix}\right.\)
\(\rightarrow m=0,45.80+0,09.160+0,015.64=18,96\left(g\right)\)