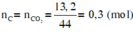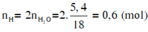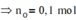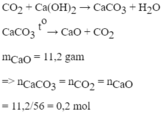Đốt 6g một chất hữu cơ X sản phẩm khí C O 2 và hơi H 2 O cho qua bình 1 đựng H 2 S O 4 đặc, sau đó cho qua bình 2 đựng dung dịch NaOH dư, khối lượng 2 bình tăng lần lượt là 3,6g và 8,8g. Tìm công thức đơn giản nhất của X (cho H=1, C=12, O=16).

Những câu hỏi liên quan
20. Đốt cháy hoàn toàn 15g một hợp chất hữu cơ chứa ( C,H,O,N) bằng V lít ko khí vừa đủ ( 80% N2 , 20% O2 về thể tích). Dẫn toàn bộ sản phẩm cháy lần lượt lội qua bình đựng dd H2SO4 đặc , bình 2 đựng dd Ca(OH)2 dư thì còn lại 42,56 lít một khí X ko bị hấp thụ . Biết rằng khối lượng bình 1 tăng thêm 9 gam , khối lượng bình 2 tăng thêm 17,6g . Công thức đơn giản nhất của hợp chất trên là?
Đọc tiếp
20. Đốt cháy hoàn toàn 15g một hợp chất hữu cơ chứa ( C,H,O,N) bằng V lít ko khí vừa đủ ( 80% N2 , 20% O2 về thể tích). Dẫn toàn bộ sản phẩm cháy lần lượt lội qua bình đựng dd H2SO4 đặc , bình 2 đựng dd Ca(OH)2 dư thì còn lại 42,56 lít một khí X ko bị hấp thụ . Biết rằng khối lượng bình 1 tăng thêm 9 gam , khối lượng bình 2 tăng thêm 17,6g . Công thức đơn giản nhất của hợp chất trên là?
Đốt cháy hoàn toàn 0,05 mol hợp chất hữu cơ A chỉ chứa C, H, O với khí oxi theo tỉ lệ mol phản ứng là 1:2. Toàn bộ sản phẩm cháy được cho qua bình 1 đựng dung dịch PdCl2 dư rồi qua bình 2 đựng dung dịch Ca(OH)2 dư. Sau thí nghiệm, bình 1 tăng 0,2 gam và xuất hiện 10,6 gam kết tủa. Bình 2 có 15 gam kết tủa. Công thức phân tử của chất hữu cơ A là A. C3H6O2 B. C3H4O2 C. C2H6O D. C2H4O
Đọc tiếp
Đốt cháy hoàn toàn 0,05 mol hợp chất hữu cơ A chỉ chứa C, H, O với khí oxi theo tỉ lệ mol phản ứng là 1:2. Toàn bộ sản phẩm cháy được cho qua bình 1 đựng dung dịch PdCl2 dư rồi qua bình 2 đựng dung dịch Ca(OH)2 dư. Sau thí nghiệm, bình 1 tăng 0,2 gam và xuất hiện 10,6 gam kết tủa. Bình 2 có 15 gam kết tủa. Công thức phân tử của chất hữu cơ A là
A. C3H6O2
B. C3H4O2
C. C2H6O
D. C2H4O
Đáp án B
Vì sau phản ứng, dẫn sản phẩm cháy vào bình đựng PdCl2 thấy xuất hiện kết tủa nên trong sản phẩm thu được có chứa CO:
![]()
Tiếp tục dẫn khí qua bình 2 chứa dung dịch Ca(OH)2 dư xuất hiện kết tủa nên khí bị hấp thụ là CO2 gồm CO2 tạo thành từ phản ứng (1) và có thể gồm CO2 sản phẩm cháy:
![]()
![]()
![]()

![]()
![]()
![]()


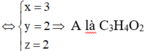
Đúng 0
Bình luận (0)
Hợp chất hữu cơ X chứa C, H, O. Đốt cháy hoàn toàn 7,4 gam X rồi dẫn sản phẩm cháy qua bình 1 đựng H2SO4 đặc và bình 2 đựng dung dịch KOH dư thấy khối lượng bình 1 và bình 2 tăng lần lượt 5,4 gam và 13,2 gam. Hãy xác định hàm lượng % các nguyên tố C, H, O trong X.
Khi đốt cháy hoàn toàn 9,4 gam hợp chất hữu cơ X chứa C, H,O có CTPT trùng CTDGN . Dẫn sản phẩm thu được qua bình 1 đựng H2SO4 đặc , bình 2 đựng nước vôi trong dư, thấy bình 1 tăng 5,4 gam; bình 2 tăng 26, 4 gam. có 50 gam kết tủa và khối lượng dung dịch giảm 13,6 gam. X có khả năng phản ứng với dung dịch NaOH. Cho 4,7 gam X vào 100ml dung dịch NaOH 1 M . Cô cạn dung dịch thu được m gam rắn. Giá trị của m là?
Đọc tiếp
Khi đốt cháy hoàn toàn 9,4 gam hợp chất hữu cơ X chứa C, H,O có CTPT trùng CTDGN . Dẫn sản phẩm thu được qua bình 1 đựng H2SO4 đặc , bình 2 đựng nước vôi trong dư, thấy bình 1 tăng 5,4 gam; bình 2 tăng 26, 4 gam. có 50 gam kết tủa và khối lượng dung dịch giảm 13,6 gam. X có khả năng phản ứng với dung dịch NaOH. Cho 4,7 gam X vào 100ml dung dịch NaOH 1 M . Cô cạn dung dịch thu được m gam rắn. Giá trị của m là?
Có lẽ đoạn đề ". có 50 gam... 13,6 gam." bị thừa bạn nhỉ?
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
\(n_{CO_2}=\dfrac{26,4}{44}=0,6\left(mol\right)=n_C\)
⇒ mC + mH = 0,6.12 + 0,6.1 = 7,8 (g) < 9,4 (g)
→ X gồm C, H và O.
⇒ mO = 9,4 - 7,8 = 1,6 (g) \(\Rightarrow n_O=\dfrac{1,6}{16}=0,1\left(mol\right)\)
Gọi CTPT của X là CxHyOz.
⇒ x:y:z = 0,6:0,6:0,1 = 6:6:1
Mà: CTPT của X trùng với CTĐGN.
→ X là C6H6O.
- X có pư với NaOH → CTCT: C6H5OH.
\(n_X=\dfrac{4,7}{94}=0,05\left(mol\right)\), \(n_{NaOH}=0,1.1=0,1\left(mol\right)\)
PT: \(C_6H_5OH+NaOH\rightarrow C_6H_5ONa+H_2O\)
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,1}{1}\), ta được NaOH dư.
Chất rắn thu được sau cô cạn gồm: NaOH dư và C6H5ONa.
Theo PT: \(n_{NaOH\left(pư\right)}=n_{C_6H_5ONa}=n_{C_6H_5OH}=0,05\left(mol\right)\)
\(\Rightarrow n_{NaOH\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
⇒ m chất rắn = 0,05.40 + 0,05.116 = 7,8 (g)
Đúng 2
Bình luận (0)
Đốt cháy hoàn toàn 5,8 gam hợp chất hữu cơ X gồm ( C, H, O). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch
H
2
SO
4
đặc, bình (2) dựng dung dịch KOH dư. Sau thí nghiệm khối lượng bình (1) tăng 5,4 gam, khối lượng bình (2) tăng 13,2 gam. Tỉ khối hơi của X đối với
CO
2
nhỏ hơn 2. Công thức phân tử của X là A.
C
3...
Đọc tiếp
Đốt cháy hoàn toàn 5,8 gam hợp chất hữu cơ X gồm ( C, H, O). Dẫn sản phẩm cháy lần lượt qua bình (1) đựng dung dịch H 2 SO 4 đặc, bình (2) dựng dung dịch KOH dư. Sau thí nghiệm khối lượng bình (1) tăng 5,4 gam, khối lượng bình (2) tăng 13,2 gam. Tỉ khối hơi của X đối với CO 2 nhỏ hơn 2. Công thức phân tử của X là
A. C 3 H 8 O
B. C 3 H 6 O
C. C 6 H 12 O 2
D. C 3 H 6 O 2
Đốt cháy hoàn toàn một chất hữu cơ A chứ C, H,O. Cho sản phẩm cháy vào bình đựng 35ml dd KOH 1M. Sau phản ứng người ta nhận thấy bình đựng KOH tăng lên 1,15g đồng thời trong bình xuất hiện 2 muối có khối lượng tổng cộng là 2,57g. Tỷ khối hơi của A so với hidro là 43. Tìm CTPT của A.
Ta có: \(n_{KOH}=0,035.1=0,035\left(mol\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{KHCO_3}=x\left(mol\right)\\n_{K_2CO_3}=y\left(mol\right)\end{matrix}\right.\)
⇒ 100x + 138y = 2,57 (1)
PT: \(CO_2+KOH\rightarrow KHCO_3\)
\(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
⇒ x + 2y = 0,035 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,005\left(mol\right)\\y=0,015\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{CO_2}=0,005+0,015=0,02\left(mol\right)=n_C\)
Mà: m bình tăng = mCO2 + mH2O
\(\Rightarrow m_{H_2O}=1,15-0,02.44=0,27\left(g\right)\Rightarrow n_{H_2O}=\dfrac{0,27}{18}=0,015\left(mol\right)\)
\(\Rightarrow n_H=0,015.2=0,03\left(mol\right)\)
Giả sử CTPT của A là CxHyOz.
⇒ x:y = 0,02:0,03 = 2 : 3
⇒ CTĐGN của A là: (C2H3Ot)n.
Mà: MA = 43.2 = 86 (g/mol)
⇒ (27+16t)n = 86
Với n = 1 ⇒ t = 3,6875 (loại)
n = 2 ⇒ t = 1 (nhận)
n = 3 ⇒ t = 0,104 (loại)
Vậy: A là C4H6O2
Bạn tham khảo nhé!
Đúng 2
Bình luận (1)
Sản phẩm tạo thành khi phân tích chất X cho qua bình 1 đựng
C
u
S
O
4
khan, sau đó cho qua bình 2 đựng dung dịch
C
a
(
O
H
)
2
dư. Thu được kết quả sau:a) Bình 1 một phần màu trắng chuyển sang màu xanh, bình 2 khối lượng tăng lên. Hỏi X là hợp chất hay đơn chất? chất hữu cơ hay vô cơ? Có thể có mặt nhữ...
Đọc tiếp
Sản phẩm tạo thành khi phân tích chất X cho qua bình 1 đựng C u S O 4 khan, sau đó cho qua bình 2 đựng dung dịch C a ( O H ) 2 dư. Thu được kết quả sau:
a) Bình 1 một phần màu trắng chuyển sang màu xanh, bình 2 khối lượng tăng lên. Hỏi X là hợp chất hay đơn chất? chất hữu cơ hay vô cơ? Có thể có mặt những nguyên tố nào?
b) Cho khối lượng chất X là 6g, bình 1 tăng 3,6g, lọc kết tủa ở bình 2 rồi nhiệ phân hoàn toàn chất kết tủa, thu được 11,2 g chất rắn.
Xác định thành phần % theo khối lượng của các nguyên tố trong X.
(Cho H=1, C=12, O=16, Ca=40)
Đốt cháy hoàn toàn 5,4 gam hợp chất hữu cơ thơm X (trong phân tử chỉ chứa C, H, O) sản phẩm thu được lần lượt cho qua bình 1 đựng H2SO4 đặc, bình 2 đựng dung dịch Ca(OH)2 dư sau phản ứng thấy bình 1 tăng 3,6 gam, bình 2 tạo thành 35 gam kết tủa. X tác dụng được với Na sinh ra H2 và MX 120. Số công thức cấu tạo của X là: A. 4 B. 1 C. 2 D. 3
Đọc tiếp
Đốt cháy hoàn toàn 5,4 gam hợp chất hữu cơ thơm X (trong phân tử chỉ chứa C, H, O) sản phẩm thu được lần lượt cho qua bình 1 đựng H2SO4 đặc, bình 2 đựng dung dịch Ca(OH)2 dư sau phản ứng thấy bình 1 tăng 3,6 gam, bình 2 tạo thành 35 gam kết tủa. X tác dụng được với Na sinh ra H2 và MX < 120. Số công thức cấu tạo của X là:
A. 4
B. 1
C. 2
D. 3
Đáp án A
nCO2=nCaCO3=35/100=0,35 mol
nH2O=3,6/18=0,2 mol
=>mO=mX-mC-mH=5,4 -12.0,35-1.2.0,2=0,8 g
=> nO=0,05 mol
nC:nH:nO=0,35:0,4:0,05=7:8:1
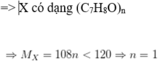
=> CTPT của X là C7H8O
X phản ứng với Na suy ra X có nhóm -OH => Các CTCT của X là
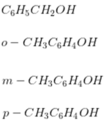
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm chảy lần lượt qua bình (1) đựng dung dịch
H
2
SO
4
đặc, bình (2) đụng dung dịch KOH dư, sau thí nghiệm, khối lượng bình (1) tăng 7,2 gam, khối lượng bình (2) tăng 17,6 gam. Thành phần phần trămkhối lượng oxi trong X là A. 36,36% B. 27,27% C. 40,91% D. 54,54%.
Đọc tiếp
Đốt cháy hoàn toàn 8,8 gam hợp chất hữu cơ X ( C, H, O ). Dẫn sản phẩm chảy lần lượt qua bình (1) đựng dung dịch H 2 SO 4 đặc, bình (2) đụng dung dịch KOH dư, sau thí nghiệm, khối lượng bình (1) tăng 7,2 gam, khối lượng bình (2) tăng 17,6 gam. Thành phần phần trămkhối lượng oxi trong X là
A. 36,36%
B. 27,27%
C. 40,91%
D. 54,54%.
Đáp án A
m bình (1) tăng = mH2O = 7,2 gam → mH = 0,8 gam
m bình (2) tăng = mCO2 = 17,6 gam → mC = 4,8 gam
ð mO = mX – mH – mC = 3,2 gam
ð %m O = 36,36%
Đúng 0
Bình luận (0)