Trung hòa 200 gam dung dịch NaOH 10% bằng dung dịch HCl 3,65%. Khối lượng dung dịch HCl cần dùng là
A. 200 gam
B. 300 gam
C. 400 gam
D. 500 gam
Câu 1.cho 200 ml dung dịch HCl 2M Trung Hòa vừa đủ với 200 ml dung dịch NaOH* tính nồng độ mol của dung dịch NaOH cần dùng Câu 2.để trung hòa 200 g dung dịch NaOH 10% thì phải dùng 6 gam dung dịch HCl 3,65% là bao nhiêu?câu 3.Cho các chất sau NaHCO3 CaOH2 CO2 Na2CO3 Ba(NO3)2 Fe2O3 và N2O5 al2o *chất nào tác dụng với dung dịch HCl, dung dịch,H2SO4 loãng* Viết các phương trình phản ứng
Câu 1:
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{HCl}=0,2\cdot2=0,4\left(mol\right)=n_{NaOH}\)
\(\Rightarrow C_{M_{NaOH}}=\dfrac{0,4}{0,2}=2\left(M\right)\)
Câu 2: Bạn xem lại đề !!
Câu 2:
PTHH: \(NaOH+HCl\rightarrow NaCl+H_2O\)
Ta có: \(n_{NaOH}=\dfrac{200\cdot10\%}{40}=0,5\left(mol\right)=n_{HCl}\)
\(\Rightarrow m_{ddHCl}=\dfrac{0,5\cdot36,5}{3,65\%}=500\left(g\right)\)
Câu 3:
\(NaHCO_3+HCl\rightarrow NaCl+H_2O+CO_2\uparrow\)
\(Ca\left(OH\right)_2+HCl\rightarrow CaCl_2+H_2O\)
\(Na_2CO_3+2HCl\rightarrow2NaCl+H_2O+CO_2\uparrow\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
*Các chất trên tác dụng tương tự với H2SO4 loãng
Bonus: \(Ba\left(NO_3\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HNO_3\)
Để trung hòa hết 200g dung dịch HCl 7.3% cần dùng m gam dung dịch NaOH 10%
a)Tính m gam khối lượng dung dịch NaOH 10% đã dùng?
b)Xác định nồng độ phần trăm (C%) dung dịch muối thu được
Trả lời:
mk chx hok wa lớp 9 nên ko giúp đc, thông cảm
HT^^
\(NaOH+HCl->NaCl+H_2O\)
a, \(m_{HCl}=\frac{C\%.m_{\text{dd}HCl}}{100\%}=\frac{7,3\%.200}{100\%}=14.6g\)
\(n_{HCl}=\frac{m_{HCl}}{M_{HCl}}=\frac{14.6}{36.5}=0.4\left(mol\right)\)
Theo PTHH ta có:\(n_{HCl}=n_{NaOH}=0.4\left(mol\right)\)
\(\Rightarrow m_{NaOH}=0,4.40=16g\)
\(\Rightarrow m_{\text{dd}NaOH}=\frac{m_{NaOH}.100\%}{C\%}=\frac{16.100\%}{10\%}=160g\)
b, Ta có \(\frac{C\%_{\text{dd}NaOH}-C\%_{\text{dd}mu\text{ối}}}{C\%_{\text{dd}mu\text{ối}}-C\%_{\text{dd}HCl}}=\frac{m_{\text{dd}HCl}}{m_{\text{dd}NaOH}}\)
\(\Leftrightarrow\frac{10\%-C\%}{C\%-7,3\%}=\frac{200}{160}=\frac{5}{4}\)\(\Rightarrow4\left(10\%-C\%\right)=5\left(C\%-7.3\%\right)\Leftrightarrow40\%-4C\%=5C\%-36.5\%\)
\(\Leftrightarrow9C\%=76.5\%\Leftrightarrow C\%=8,5\%\)
Bài 1 : Cho 25 gam hỗn hợp X gồm Mg và Zn vào cốc đựng 200 ml dung dịch HCl, cô cạn cốc X được 53,4 gam chất rắn . Nếu cũng cho 25 gam hỗn hợp X vào cốc chứa 400 ml dung dịch HCl trên, khi cô cạn cốc X được 74,7 gam chất rắn. Tính khối lượng của Mg trong X
Bài2 : Hòa tan 8 gam hỗn hợp gồm Fe và kim loại M có hóa trị II vào 500 gam dung dịch HCl có nồng độ 3,65% giải phóng 4,48 lít khí (đktc) . Mặt khác, đẻ hòa tan 4,8 gam M cần chưa đến 500 ml dung dịch HCl 1M . Xác định tên kim loại M và tính thàn phần % khối lượng mỗi kim loại trong hỗn hợp đầu
Bài 2: Hòa tan hoàn toàn m gam kim loại Mg cần dùng 200 gam dung dịch HCl vừa đủ được dung dịch A và 4,48 lit khí.
a. Tính m(khối lượng Mg) và C% của dung dịch HCl đã dùng.
b. Tính C% của chất tan trong dung dịch A thu được sau phản ứng.
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
a. PTHH: \(Mg+2HCl--->MgCl_2+H_2\)
Theo PT: \(n_{Mg}=n_{H_2}=0,2\left(mol\right)\)
=> \(m_{Mg}=0,2.24=4,8\left(g\right)\)
Theo PT: \(n_{HCl}=2.n_{Mg}=2.0,2=0,4\left(mol\right)\)
=> \(m_{HCl}=0,4.36.5=14,6\left(g\right)\)
=> \(C_{\%_{HCl}}=\dfrac{14,6}{200}.100\%=7,3\%\)
b. Ta có: \(m_{dd_{MgCl_2}}=4,8+200=204,8\left(g\right)\)
Theo PT: \(n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\)
=> \(m_{MgCl_2}=0,2.95=19\left(g\right)\)
=> \(C_{\%_{MgCl_2}}=\dfrac{19}{204,8}.100\%=9,28\%\)
Hòa tan 21,1 gam hỗn hợp A gồm Zn và ZnO bằng 200 gam dung dịch HCl ( vừa đủ ) thu được dung dịch B và 4,48 lít khí H2
a, Xác định khối lượng mỗi chất có trong hỗn hợp A
b, Tính C% của dung dịch HCl đã dùng
c, Tính khối lượng muối có trong dung dịch B
Zn+2HCl->ZnCl2+H2
ZnO+2HCl->ZnCl2+H2O
nH2=0.2(mol)->nZn=0.2(mol).mZn=13(g)
mZnO=21.1-13=8.1(g)
nZnO=0.1(mol)
Tổng nHCl cần dùng:0.2*2+0.1*2=0.6(mol)
mHCl=21.9(g)
C%ddHCl=21.9:200*100=10.95%
n muối=0.2+.1=0.3(mol)
m muối=40.8(g)
Hòa tan hết 3,9 gam K vào H2O được dung dịch X. Thể tích dung dịch HCl 1M cần để phản ứng hết với dung dịch X là:
A. 100 ml.
B. 200 ml.
C. 300 ml.
D. 400 ml
: Cho 4 gam một kim loại M hóa trị II tác dụng hết với H2O thu được 2,24 lít khí (đktc) và 500 gam dung dịch A.
a) Xác định tên của kim loại M và tính C% của dung dịch A
b) Để trung hòa hết 200 gam dung dịch A cần phải dùng bao nhiêu ml dung dịch HCl 2M
a, \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: M + 2H2O → M(OH)2 + H2
Mol: 0,1 0,1 0,1
\(\Rightarrow M_M=\dfrac{4}{0,1}=40\left(g/mol\right)\)
⇒ M là canxi (Ca)
\(C\%_{ddCa\left(OH\right)_2}=\dfrac{0,1.74.100\%}{500}=1,48\%\)
b) \(m_{Ca\left(OH\right)_2}=200.1,48=2,96\left(g\right)\Rightarrow n_{Ca\left(OH\right)_2}=\dfrac{2,96}{74}=0,04\left(mol\right)\)
PTHH: Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Mol: 0,04 0,08
\(V_{ddHCl}=\dfrac{0,08}{2}=0,04\left(l\right)=40\left(ml\right)\)
Cần dùng 300 gam dung dịch HCl 3,65% để hòa tan vừa hết x gam Al2O3. Giá trị của x là
A. 51
B. 5,1
C. 153
D. 15,3
Đáp án B
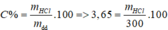
=> mHCl = 10,85 (g), nHCl = 0,3 (mol)
Al2O3 + 6HCl → 2AlCl3 + 3H2O
0,05 ← 0,3 (mol)
X = 0,05.(27.2 + 16.3) = 5,1(g)
Hòa tan 13 gam Kẽm cần vừa đủ 500ml dung dịch HCL có nồng độ Cm a) tính nồng độ dung dịch HCL đã dùng b) tính khối lượng muối tạo thành và thể tích H2 sinh ra ở điều kiện tiêu chuẩn c) nếu cho lượng axít trên vào 200 gam dung dịch KOH 5,6% sau đó cho mẫu quỳ tím vào dung dịch thu được sau phản ứng thì màu của quỳ tím thế nào? giải thích
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{13}{65}=0,2mol\)
PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
TL: 1 : 2 : 1 : 1
mol: 0,2 \(\rightarrow\) 0,1 \(\rightarrow\) 0,2 \(\rightarrow\) 0,2
đổi 500ml = 0,5 l
\(a.C_{M_{ddHCl}}=\dfrac{n_{HCl}}{V_{HCl}}=\dfrac{0,1}{0,5}=0,2M\)
\(b.m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
c.
Màu của quỳ tím sẽ chuyển sang màu đỏ.
Giải thích:
- Phản ứng giữa axit HCl và bazơ KOH tạo ra muối KCl và nước: HCl + KOH → KCl + H2O
- Vì dung dịch KOH là bazơ, nên khi phản ứng với axit HCl thì sẽ tạo ra dung dịch muối KCl và nước.
- Muối KCl không có tính kiềm, nên dung dịch thu được sẽ có tính axit.
- Khi cho mẫu quỳ tím vào dung dịch axit, quỳ tím sẽ chuyển sang màu đỏ do tính axit của dung dịch.
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Pt : \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2----->0,4------>0,2---->0,2
a) \(C_{MddHCl}=\dfrac{0,4}{0,5}=0,8M\)
b) \(m_{muối}=m_{ZnCl2}=0,2.136=27,2\left(g\right)\)
\(V_{H2\left(dktc\right)}=0,2.22,4=4,48\left(l\right)\)
c) \(n_{KOH}=\dfrac{5,6\%.200}{100\%.56}=0,2\left(mol\right)\)
Pt : \(KOH+HCl\rightarrow KCl+H_2O\)
0,2 0,4
Xét tỉ lệ : \(0,2< 0,4\Rightarrow HCldư\)
Khi cho quỳ tím vào dụng dịch sau phản ứng --> quỳ hóa đỏ (do HCl có tính axit)