Khi nung thanh sắt rong không khí thì khối lượng thanh sắt sau phản ứng thay đổi như thế nào?

Những câu hỏi liên quan
a) Khi nung nóng canxi cacbonat (CaCO3) ở nhiệt độ cao trong lò nung, thu được canxi oxit và khí CO2. Khối lượng chất rắn thu được sau phản ứng thay đổi như thế nào so với chất rắn ban đầu?
b) Khi nung thanh sắt rong không khí thì khối lượng thanh sắt sau phản ứng thay đổi như thế nào?
Mấy cái này bn lên mạng mà tìm, nó có hết á. Mấy câu bn đăg lên toàn là những câu có trên mạng. Sao ko tìm đi. ![]()
Tham khảo:
Vì khi nung CaCO3, khí CO2 thoát ra nên khối lượng chất rắn thu được sau phản ứng giảm. Phương trình hóa học :
CaCO3 →t° CaO + CO2
Vì khi nugn thanh sắt thì sắt sẽ kết hợp với oxi tạo oxit sắt nên khối lượng tăng sau phản ứng.
Đúng 0
Bình luận (13)
Vì khi nung CaCO3, khí CO2 thoát ra nên khối lượng chất rắn thu được sau phản ứng giảm. Phương trình hóa học :
CaCO3 →t° CaO + CO2
Vì khi nugn thanh sắt thì sắt sẽ kết hợp với oxi tạo oxit sắt nên khối lượng tăng sau phản ứng.
Đúng 0
Bình luận (0)
Tham khảo trên mạng nà:
Khi nung nóng đá vôi (CaCO3) thì sẽ xảy ra phản ứng:
\(CaCO_3\rightarrow CaO+CO_2\). Mà khí CO2 sẽ bay hơi hết nên khối lượng sẽ giảm đi.
Đúng 0
Bình luận (0)
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau: Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào? A. Tăng 0,032 gam B. Giảm 0,256 gam C. Giảm 0,56 gam D. Giảm 0,304 gam
Đọc tiếp
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:

Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào?
A. Tăng 0,032 gam
B. Giảm 0,256 gam
C. Giảm 0,56 gam
D. Giảm 0,304 gam
Chọn đáp án D.
Điện phân trong 2895s:
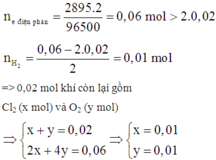
· Trong khoảng thời gian từ (t + 2895) s đến 2s chỉ là điện phân H2O nên phần khí tăng thêm là 2,125a - a - 0,03 = 1,125a - 0,03 chỉ gồm O2 và H2
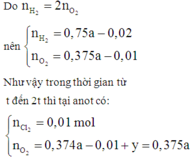
· Bảo toàn electron cho cực dương ở 2 khoảng thời gian (0 – t) và (t – 2t) có:2a = 0,01.2 + 0,375A.4 => a = 0,04 => b = 0,04
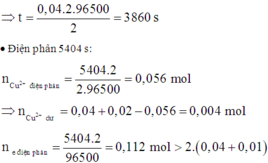
=> Tại anot đã xảy ra điện phân H2O:
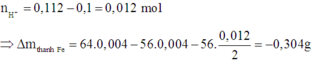
=> Khối lượng thanh sắt giảm 0,304 g
Đúng 0
Bình luận (0)
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào?
Đọc tiếp
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau
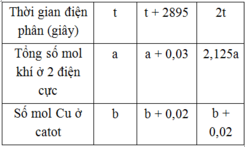
Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào?
![]()
![]()
![]()
![]()
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau: Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào? A. Tăng 0,032 gam B. Giảm 0,256 gam C. Giảm 0,56 gam D. Giảm 0,304 gam
Đọc tiếp
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:
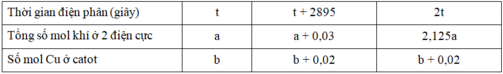
Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào?
A. Tăng 0,032 gam
B. Giảm 0,256 gam
C. Giảm 0,56 gam
D. Giảm 0,304 gam
Chọn đáp án D.
Điện phân trong 2895s:
n đ i ệ n p h â n = 2895 . 2 96500 = 0 , 06 m o l > 2 . 0 , 02
⇒ n H 2 = 0 , 06 - 2 . 0 , 02 2 = 0 , 01 m o l
=> 0,02 mol khí còn lại gồm Cl2 (x mol) và O2 (y mol)
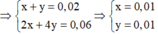
Trong khoảng thời gian từ (t + 2895) s đến 2s chỉ là điện phân H2O
nên phần khí tăng thêm là 2 , 125 a - a - 0 , 03 = 1 , 125 a - 0 , 03 chỉ gồm O2 và H2
Do n H 2 = 2 n O 2
nên n H 2 = 0 , 75 a - 0 , 02 n O 2 = 0 , 375 a - 0 , 01
Như vậy trong thời gian từ t đến 2t thì tại anot có:
⇒ n C l 2 = 0 , 01 m o l n O 2 = 0 , 374 a - 0 , 01 + y = 0 , 375 a
Bảo toàn electron cho cực dương ở 2 khoảng thời gian (0 – t) và (t – 2t) có:
![]()
![]()
![]()
Điện phân 5404 s:
n C u 2 + đ i ệ n p h â n = 5404 . 2 2 . 96500 = 0 , 056 m o l
⇒ n C u 2 + = 0 , 04 + 0 , 02 - 0 , 056 = 0 , 004 m o l
⇒ Tại anot đã xảy ra điện phân H2O:
n H + = 0 , 112 - 0 , 1 = 0 , 012 m o l
⇒ ∆ m t h a n h F e = - 0 , 304 g
=> Khối lượng thanh sắt giảm 0,304 g
Đúng 0
Bình luận (0)
a)khi nung nóng canxi cacbonat ở nhiệt độ cao thu được canxi oxit và cacbon .khối lượng chất rắn thay đổi nhu thế nào so với chất rắn ban đầu.
b) khi nung thanh sắt trongkhoong khí thì khối lượng thanh sắt thay đổi như thế nào so vs thanh sắt ban đầu
a.khối lượng chất rắn sẽ giảm so với ban đầu
b.khối lượng thanh sắt sẽ tăng so với ban đầu
Đúng 0
Bình luận (0)
Điện phân với hai điện cực trơ 200ml dung dịch chứa hỗn hợp NaCl 1,2M và CuSO4 1M trong thời gian t giây, I 5A thì thu được dung dịch X và V lít hỗn hợp khí Y ở anot (đktc). Nhúng một thanh sắt vào X đến khi phản ứng xảy ra hoàn toàn rồi nhấc thanh sắt ra đem cân lại thấy khối lượng thanh sắt không bị thay đổi. Kết luận nào sau đây đúng? A. Thanh Fe không có phản ứng với dung dịch X B. Dung dịch X có môi trường bazơ C. t 5018 giây D. V 2,688 lít
Đọc tiếp
Điện phân với hai điện cực trơ 200ml dung dịch chứa hỗn hợp NaCl 1,2M và CuSO4 1M trong thời gian t giây, I = 5A thì thu được dung dịch X và V lít hỗn hợp khí Y ở anot (đktc). Nhúng một thanh sắt vào X đến khi phản ứng xảy ra hoàn toàn rồi nhấc thanh sắt ra đem cân lại thấy khối lượng thanh sắt không bị thay đổi. Kết luận nào sau đây đúng?
A. Thanh Fe không có phản ứng với dung dịch X
B. Dung dịch X có môi trường bazơ
C. t = 5018 giây
D. V = 2,688 lít
Thả một thanh chì kim loại vào 100ml dng dịch chứa 2 muối Cu(NO3)2 0,5M và AgNO3 2M.Sau phản ứng lấy thanh chì ra khỏi dung dịch làm khô thì khối lượng thanh sắt thay đổi như thế nào?
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:
Thời gian điện phân (giây)
t
t + 2895
2t
Tổng số mol khí ở 2 điện cực
a
a + 0,03
2,125a
Số mol Cu ở catot
b
b + 0,02
b + 0,02
Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượn...
Đọc tiếp
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:
| Thời gian điện phân (giây) |
t |
t + 2895 |
2t |
| Tổng số mol khí ở 2 điện cực |
a |
a + 0,03 |
2,125a |
| Số mol Cu ở catot |
b |
b + 0,02 |
b + 0,02 |
Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào ?
A. Giảm 0,304 gam
B. Giảm 0,256 gam
C. Tăng 0,032 gam
D. Giảm 0,56 gam
Đáp án A
Gọi số mol e lúc t giây là x.
Túc t giây thu được a mol khí ở 2 điện cực và b mol Cu.
Lúc t+2895s thì số mol e là x+0,06 mol thì thu được a+0,03 mol khí và b+0,02 mol Cu.
Ta có: 0,02. 2 < 0,06
chứng tỏ lúc này Cu2+ hết ở catot thu được thêm 0,02 mol Cu và 0,01 mol H2.
Vậy ở anot thu được 0,02 mol khí do vậy khí này gồm cả Cl2 và O2, giải được số mol Cl2 và O2 đều là 0,01 mol.
Vậy lúc t giây thu được số mol Cu là 0,5x=b và khí chỉ là Cl20,5x=a.
Lúc 2t giây thu được 2,125a mol khí và a+0,02 mol Cu.
Số mol e lúc này là 2x.
Ở catot thu được số mol H2 là
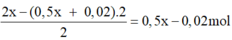
Ở anot thu được Cl2 là 0,5x +0,01 mol và O2

![]()
![]()
Giải được: x=0,08.
Vậy dung dịch ban đầu chứa CuSO4 0,06 mol và NaCl 0,1 mol.
Dừng điện phân ở thời điểm 5404 giây tức số mol e là 0,112 mol.
Ở catot thu được Cu: 0,056 mol.
Ở anot thu được Cl2 0,05 mol và O2 0,003 mol.
Do vậy dung dịch sau điện phân chứa Cu2+ dư 0,004 mol, H+ 0,012 mol, Na+ và SO42-.
Khi cho thanh Fe vào thì khối lượng thanh Fe giảm đi
![]()
Đúng 0
Bình luận (0)
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:
Thời gian điện phân (giây)
t
t + 2895
2t
Tổng số mol khí ở 2 điện cực
a
a + 0,03
2,125a
Số mol Cu ở catot
b
b + 0,02
b + 0,02
Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượn...
Đọc tiếp
Điện phân dung dịch chứa CuSO4 và NaCl với điện cực trơ, cường độ dòng điện không đổi 2A, hiệu suất 100%. Kết quả thí nghiệm được ghi trong bảng sau:
| Thời gian điện phân (giây) |
t |
t + 2895 |
2t |
| Tổng số mol khí ở 2 điện cực |
a |
a + 0,03 |
2,125a |
| Số mol Cu ở catot |
b |
b + 0,02 |
b + 0,02 |
Nếu dừng điện phân ở thời điểm 5404 giây rồi nhúng thanh sắt dư vào dung dịch, sau khi phản ứng hoàn toàn, khối lượng thanh sắt thay đổi như thế nào ?
A. Giảm 0,304 gam
B. Giảm 0,256 gam
C. Tăng 0,032 gam
D. Giảm 0,56 gam
Đáp án A
Gọi số mol e lúc t giây là x.
Túc t giây thu được a mol khí ở 2 điện cực và b mol Cu.
Lúc t+2895s thì số mol e là x+0,06 mol thì thu được a+0,03 mol khí và b+0,02 mol Cu.
Ta có: 0,02. 2 < 0,06
chứng tỏ lúc này Cu2+ hết ở catot thu được thêm 0,02 mol Cu và 0,01 mol H2.
Vậy ở anot thu được 0,02 mol khí do vậy khí này gồm cả Cl2 và O2, giải được số mol Cl2 và O2 đều là 0,01 mol.
Vậy lúc t giây thu được số mol Cu là 0,5x=b và khí chỉ là Cl20,5x=a.
Lúc 2t giây thu được 2,125a mol khí và a+0,02 mol Cu.
Số mol e lúc này là 2x.
Ở catot thu được số mol H2 là 2 x - 0 , 5 x + 0 , 02 . 2 2 = 0 , 5 x - 0 , 02 mol
Ở anot thu được Cl2 là 0,5x +0,01 mol và O2 2 x - 0 , 5 x + 0 , 01 . 2 4 = 0 , 25 x - 0 , 005
→ 0,5x - 0,02 +0,5x + 0,01 + 0,25x - 0,005 = 2,125a = 2,125.0,5x
Giải được: x=0,08.
Vậy dung dịch ban đầu chứa CuSO4 0,06 mol và NaCl 0,1 mol.
Dừng điện phân ở thời điểm 5404 giây tức số mol e là 0,112 mol.
Ở catot thu được Cu: 0,056 mol.
Ở anot thu được Cl2 0,05 mol và O2 0,003 mol.
Do vậy dung dịch sau điện phân chứa Cu2+ dư 0,004 mol, H+ 0,012 mol, Na+ và SO42-.
Khi cho thanh Fe vào thì khối lượng thanh Fe giảm đi 0,006.56 - 0,004(64 - 56) = 0,304 gam
Đúng 0
Bình luận (0)















