Nung nóng m gam Fe với 6,4 gam bột S một thời gian được hỗn hợp chất rắn X. Cho X tác dụng với dd HCl dư thấy có 6,72 lít hỗn hợp khí Y (đktc) thoát ra, đồng thời có 3,2 gam chất rắn không tan. Tính giá trị của m và hiệu suất của phản ứng Fe với S?

Những câu hỏi liên quan
Để m g bột sắt ngoài không khí, sau một thời gian sẽ chuyển thành hỗn hợp X gồm 4 chất rắn có khối lượng 75,2 gam. Cho hỗn hợp X phản ứng hết với dung dịch H2SO4 đặc nóng dư thấy thoát ra 6,72 lít SO2 (đktc). Tính m? A.56g B.22,4g C. 11,2g D.25,3g
Đọc tiếp
Để m g bột sắt ngoài không khí, sau một thời gian sẽ chuyển thành hỗn hợp X gồm 4 chất rắn có khối lượng 75,2 gam. Cho hỗn hợp X phản ứng hết với dung dịch H2SO4 đặc nóng dư thấy thoát ra 6,72 lít SO2 (đktc). Tính m?
A.56g
B.22,4g
C. 11,2g
D.25,3g
Đáp án A
Coi hỗn hợp X gồm a mol Fe và b mol O.
Quá trình nhường electron:
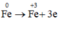
Các quá trình nhận e:
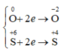
có
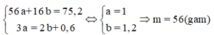
Đúng 0
Bình luận (0)
Để m g bột sắt ngoài không khí, sau một thời gian sẽ chuyển thành hỗn hợp X gồm 4 chất rắn có khối lượng 75,2 gam. Cho hỗn hợp X phản ứng hết với dung dịch H2SO4 đặc nóng dư thấy thoát ra 6,72 lít SO2 (đktc). Tính m? A.56g B.22,4g C. 11,2g D.25,3g
Đọc tiếp
Để m g bột sắt ngoài không khí, sau một thời gian sẽ chuyển thành hỗn hợp X gồm 4 chất rắn có khối lượng 75,2 gam. Cho hỗn hợp X phản ứng hết với dung dịch H2SO4 đặc nóng dư thấy thoát ra 6,72 lít SO2 (đktc). Tính m?
A.56g
B.22,4g
C. 11,2g
D.25,3g
Đáp án A
Coi hỗn hợp X gồm a mol Fe và b mol O.
Quá trình nhường electron:

Đúng 0
Bình luận (0)
Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và
Fe
3
O
4
vào bình chân không rồi nung nóng, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau. Phần một cho tác dụng với dung dịch NaOH dư thấy thoát ra 0,06 mol khí
H
2
, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần hai cho tác dụng hết với dung dịch
HNO
3
d...
Đọc tiếp
Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe 3 O 4 vào bình chân không rồi nung nóng, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau. Phần một cho tác dụng với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H 2 , đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần hai cho tác dụng hết với dung dịch HNO 3 dư, thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng Fe 3 O 4 có trong m gam X là
A. 27,84 gam
B. 21,92 gam
C. 19,21 gam
D. 24,32 gam
Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau. Phần một cho tác dụng với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần hai cho tác dụng hết với dung dịch HNO3 dư, thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng Fe3O4 có trong m gam X là A. 27,84 gam. B. 21,92 gam. C. 19,21...
Đọc tiếp
Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau. Phần một cho tác dụng với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần hai cho tác dụng hết với dung dịch HNO3 dư, thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng Fe3O4 có trong m gam X là
A. 27,84 gam.
B. 21,92 gam.
C. 19,21 gam.
D. 24,32 gam.
Giải thích:
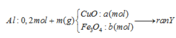
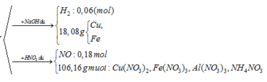
Coi trong mỗi phần có 0,2 mol Al
- Rắn Y + NaOH → 0,06 nH2
BT: e => nAl DƯ = 2/3 nH2 = 2/3. 0,06 = 0,04 ( mol)
BTNT: Al => nAl2O3 = ½ ( nAlbđ – nAl dư) = ½ ( 0,2 – 0,04) = 0,08 (mol)
BTKL: m = mFe, Cu + mO = 18,08 + 0,08.3.16 = 21,92 (g)
=> 80a + 232b = 21,92 (1)
- Rắn Y + HNO3
Sau tất cả quá trình ta có: Al → Al+3 ; Fe+8/3 → Fe+3, N+5 → N+2; N+5→ N-3
BT e ta có: 3nAl + nFe3O4 = 3nNO + 8nNH4NO3
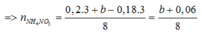
mmuối = mAl(NO3)3 + mCu(NO3)3 + mFe(NO3)3 + mNH4NO3
=>213.0,2 +188a + 242.3b + 80 ( b+0,06)/8 = 106,12 (2)
Từ (1) và (2) => a = 0,1 và b = 0,06
=> mFe3O4 = 232.2b = 232.2.0,1= 27,84 (g) ( Vì hỗn hợp ban đầu nên phải nhân đôi số liệu)
Đáp án A
Đúng 0
Bình luận (0)
Nung 1,92 gam hỗn hợp X gồm Fe và S trong bình kín không có không khí, sau một thời gian được chất rắn Y. Hòa tan hết Y trong dung dịch HNO3 đặc, nóng dư thu được dung dịch Z và V lít khí thoát ra (đktc). Cho Z tác dụng với dung dịch BaCl2 được 5,825 gam kết tủa. Giá trị của V là A. 3,136 lít. B. 4,704 lít. C. 1,568 lít. D. 1,344 lít.
Đọc tiếp
Nung 1,92 gam hỗn hợp X gồm Fe và S trong bình kín không có không khí, sau một thời gian được chất rắn Y. Hòa tan hết Y trong dung dịch HNO3 đặc, nóng dư thu được dung dịch Z và V lít khí thoát ra (đktc). Cho Z tác dụng với dung dịch BaCl2 được 5,825 gam kết tủa. Giá trị của V là
A. 3,136 lít.
B. 4,704 lít.
C. 1,568 lít.
D. 1,344 lít.
Cho 10,8 gam bột Al và m hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng thu được hỗn hợp rắn Y. Chia Y thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần 2 cho tác dụng hết với dung dịch HNO3 dư thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng của Fe3O4 có trong m gam X là A. 21,92 gam B. 24,32 gam C. 27,84 gam D. 19,21 gam
Đọc tiếp
Cho 10,8 gam bột Al và m hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng thu được hỗn hợp rắn Y. Chia Y thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần 2 cho tác dụng hết với dung dịch HNO3 dư thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng của Fe3O4 có trong m gam X là
A. 21,92 gam
B. 24,32 gam
C. 27,84 gam
D. 19,21 gam
Nung 19,4 gam hỗn hợp Fe(NO3)2 và AgNO3 một thời gian thu được hỗn hợp chất rắn X. Cho X vào được đến khi các phản ứng xảy ra hoàn toàn thu được chất rắn Y và dung dịch Z. Cho Y vào dung dịch HCl dư có 4,32 gam chất rắn không tan. Cho Z tác dụng với dung dịch HCl dư thì có khí không màu thoát ra hóa nâu trong không khí. Phần trăm khối lượng của AgNO3 trong hỗn hợp ban đầu là: A. 30,94 B. 35,05 C. 22,06 D. 30,67
Đọc tiếp
Nung 19,4 gam hỗn hợp Fe(NO3)2 và AgNO3 một thời gian thu được hỗn hợp chất rắn X. Cho X vào được đến khi các phản ứng xảy ra hoàn toàn thu được chất rắn Y và dung dịch Z. Cho Y vào dung dịch HCl dư có 4,32 gam chất rắn không tan. Cho Z tác dụng với dung dịch HCl dư thì có khí không màu thoát ra hóa nâu trong không khí. Phần trăm khối lượng của AgNO3 trong hỗn hợp ban đầu là:
A. 30,94
B. 35,05
C. 22,06
D. 30,67
Đáp án B
Z+HCl → NO
=> Chứng tỏ trong Z chứa Fe(NO3)2 => Z không chứa AgNO3 => AgNO3 đã bị nhiệt phân hết.
Chất rắn không tan là Ag:
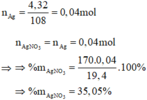
Đúng 0
Bình luận (0)
Nung 15,8 gam KMnO4 một thời gian thu được 14,84 gam hỗn hợp chất rắn. Cho 14,84 gam hỗn hợp chất rắn đó tác dụng với dd HCl đặc dư thu được V lít khí Cl2 (đktc). Tính V.
\(n_{KMnO_4}=\dfrac{15,8}{158}=0,1\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
a-------------->0,5a----->0,5a
=> 158(0,1-a) + 197.0,5a + 87.0,5a = 14,84
=> a = 0,06 (mol)
PTHH: 2KMnO4 + 16HCl --> 2KCl + 2MnCl2 + 5Cl2 + 8H2O
0,04----------------------------------->0,1
K2MnO4 + 8HCl --> 2KCl + MnCl2 + 2Cl2 + 4H2O
0,03--------------------------------->0,06
MnO2 + 4HCl --> MnCl2 + Cl2 + 2H2O
0,03--------------------->0,03
=> \(n_{Cl_2}=0,1+0,06+0,03=0,19\left(mol\right)\)
=> \(V_{Cl_2}=0,19.22,4=4,256\left(l\right)\)
Đúng 1
Bình luận (0)
Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung nóng thu được hỗn hợp rắn Y. Chia Y thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với dung dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn không tan. Phần 2 cho tác dụng hết với dung dịch HNO3 dư thu được dung dịch Z chứa 106,16 gam muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng của Fe3O4 có trong m gam X là A. 21,92 gam. B. 24,32 gam. C. 27,84 gam. D. 19...
Đọc tiếp
Cho 10,8 gam bột Al và m gam hỗn hợp X gồm CuO và Fe3O4 vào bình chân không rồi nung
nóng thu được hỗn hợp rắn Y. Chia Y thành 2 phần bằng nhau. Phần 1 cho tác dụng hết với dung
dịch NaOH dư thấy thoát ra 0,06 mol khí H2, đồng thời thu được 18,08 gam hỗn hợp chất rắn
không tan. Phần 2 cho tác dụng hết với dung dịch HNO3 dư thu được dung dịch Z chứa 106,16 gam
muối và thoát ra 0,18 mol khí NO duy nhất. Khối lượng của Fe3O4 có trong m gam X là
A. 21,92 gam.
B. 24,32 gam.
C. 27,84 gam.
D. 19,21 gam.
Đáp án C
Đồng nhất số liệu bằng cách nhân đôi giả thiết ở 2 phần
- Giải phần 1: chỉ có Al tạo khí: 2Al + 2NaOH 2NaAlO2 + 3H2 → đọc ra từ 0,12 mol H2 có 0,08 mol Al; mà
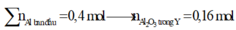
ó Phản ứng nhiệt nhôm:
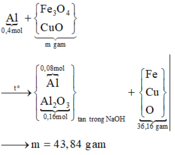
Giả sử hỗn hợp X có x mol Fe3O4 và y mol CuO ta có: 233x + 80y = 43,84 gam (1)
- Giải phần 2: vì dùng dư HNO3 nên hỗn hợp đầu hay Y tác dụng đều cho cùng sản phẩm.
ó Rõ hơn, ta có sơ đồ quá trình: 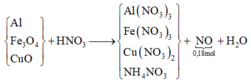
Bảo toàn electron ta có:
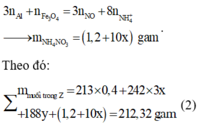
Giải hệ các phương trình (1) và (2) ta được: x = 0,12 mol và y = 0,2 mol.
Vậy, m gam X gồm 27,84 gam Fe3O4 và 16,0 gam CuO.
Đúng 0
Bình luận (0)










