Chứng minh tính axit h2s<h2co3

Những câu hỏi liên quan
các chất sau có tính axit,bazo, oxi hoá hay khử. Viết ptrimh chứng minh
cl2, Br2,I2, HCL,S,H2S,SO2,H2SO4,O2, O3
Chứng minh tính axit viết ptpu cm:
H2S<H2SO4
H2SO3<H2SO4
H2CO3<H2SO4
Tính Axit :
+ H2S < H2SO4
Na2S + H2SO4 → Na2SO4 + H2S
+ H2SO3 < H2SO4
Na2SO3 + H2SO4 → Na2SO4+ SO2 + H2O
+ H2CO3 < H2SO4
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Đúng 0
Bình luận (0)
Phản ứng không chứng minh được H2S có tính khử là
![]()
![]()
![]()
![]()
Phản ứng nào sau đây không chứng minh được H2S có tính khử? A. H2S + 4Cl2 + 4H2O
→
H2SO4 + 8HCl B. H2S + 2NaOH
→
Na2S + 2H2O C. 2H2S + 3O2
→
2H2O + 2SO2 D. 2H2S + O2
→
2H2O + 2S
Đọc tiếp
Phản ứng nào sau đây không chứng minh được H2S có tính khử?
A. H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
B. H2S + 2NaOH → Na2S + 2H2O
C. 2H2S + 3O2 → 2H2O + 2SO2
D. 2H2S + O2 → 2H2O + 2S
Cho biết gốc axit và tính hóa trị gốc axit trong các axit sau:
H
2
S
,
H
N
O
3
,
H
2
S
O
4
,
H
2
S
i
O
4
,
H...
Đọc tiếp
Cho biết gốc axit và tính hóa trị gốc axit trong các axit sau: H 2 S , H N O 3 , H 2 S O 4 , H 2 S i O 4 , H 3 P O 4
| Axit | Gốc axit | Hóa trị |
|---|---|---|
| H 2 S | S | II |
| H N O 3 | N O 3 | I |
| H 2 S O 4 | S O 4 | II |
| H 2 S i O 4 | S i O 3 | II |
| H 3 P O 4 | P O 4 | III |
Đúng 0
Bình luận (0)
Tính axit của các axit HCl, HBr, HI,
H
2
S
được sắp xếp theo trật tự nào? A.
H
C
l
H
B
r
H
I
H
2
S
B.
H
I
H
B
r
...
Đọc tiếp
Tính axit của các axit HCl, HBr, HI, H 2 S được sắp xếp theo trật tự nào?
A. H C l > H B r > H I > H 2 S
B. H I > H B r > H C l > H 2 S
C. H 2 S > H C l > H B r > H I
D. H 2 S > H I > H B r > H C l
B
H 2 S là axit yếu; HCl; HBr; HI là các axit mạnh → loại C và D
Tính axit của HI > HBr > HCl → loại A
Đúng 0
Bình luận (0)
Cho biết gốc axit và tính hóa trị của gốc axit trong các axit sau: H2S, HNO3, H2SiO3, H3PO4, HClO4, HMnO4, CH3COOH.
Theo thứ tự như đề bài: S (II), NO3 (I), SiO3 (II), PO4 (III), ClO4 (I), MnO4 (I), CH3COO (I)
Đúng 1
Bình luận (0)
Gốc axit và hóa trị của chúng lần lượt là :
-S : hóa trị 2
- NO3 : hóa trị 1
- SiO3: hóa trị 2
- PO4: hóa trị 3
- ClO4: hóa trị 1
- MnO4: hóa trị 1
- COOH : hóa trị 1
Đúng 0
Bình luận (2)
Khi khí H2S và axit H2SO4 tham gia các phản ứng oxi hóa – khử, người ta có nhận xét:
- Hidro sunfua chỉ thể hiện tính khử.
- Axit sunfuric chỉ thể hiện tính oxi hóa.
a) Hãy giải thích điều nhận xét trên.
b) Đối với mỗi chất, hãy dẫn ra một phản ứng hóa học để minh họa.
a) Khí H2S và axit sunfuric đặc tham gia các phản ứng oxi hóa – khử thì khí H2S chỉ thể hiện tính khử và H2SO4 đặc chỉ thể hiện tính oxi hóa. Vì trong H2S số oxi hóa của S chỉ có thể tăng, trong H2SO4 số oxi hóa S chỉ có thể giảm.
Vì trong H2S số oxi hóa của S là -2 (là số oxi hóa thấp nhất của S) nên chỉ có thể tăng (chỉ thể hiện tính khử), trong H2SO4 số oxi hóa của S là +6 (là số oxi hóa cao nhất của S) nên chỉ có thể giảm (chỉ thể hiện tính oxi hóa).
b) Phương trình phản ứng hóa học:
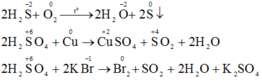
Đúng 0
Bình luận (0)
hòa tan 16,8 lít khí H2S ở đktc vào 174,5 gam nước thì thu được dung dịch Axit H2S. tính nồng độ phần trăm của dung dịch?
\(n_{H_2S}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\\\rightarrow m_{H_2S}=0,75.34=25,5\left(g\right)\\ m_{dd}=25,5+174,5=200\left(g\right)\\ \rightarrow C\%_{H_2S}=\dfrac{25,5}{200}.100\%=12,75\%\)
Đúng 1
Bình luận (0)















