Hãy viết cấu hình E của Ion Cl - cho biết cấu hình của Ion Cl-cùng với cấu hình e nguyên tử nguyên tố nào?

Những câu hỏi liên quan
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng. a. Viết cấu hình electron của Na+ và Cl-. b. Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
Cấu hình electron của ion được thiết lập bằng cách thêm hoặc bớt electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của Na+ và Cl-.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
a) Na (Z = 11) 1s22s22p63s1 ⇒ Na+: 1s22s22p6.
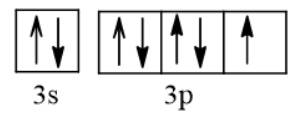
Cl (Z = 17) 1s22s22p63s23p5 ⇒ Cl-: 1s22s22p63s23p6.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp p của Cl. AO đó là AO chứa 1 electron.
Đúng 0
Bình luận (0)
Cho các nguyên tử Mg, Cl, Al, O a, Viết cấu hình e của nguyên tử, ion b, Viết phương trình cho - nhận e tạo thành phân tử MgCl2, Al2O3, MgO, AlCl3
Cấu hình electron lớp ngoài cùng của nguyên tử R và ion X2-, Y+ đều là 4s24p6.Hãy viết cấu hình electron nguyên tử R, X, Y và cho biết nguyên tố nào là phi kim, kim loại hay khí hiếm? Vì sao ?
ion x- có tổng số hạt là 29 .Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 9
a)Xác định số hạt e,nowtron va số khối của X
b)Viết cấu hình e của X và ion X-
c)Nguyên tử nguyên tố R có cấu hình e lớp vỏ ngoài cùng 3s2
-Cho biết vị trí(chu kì,nhóm) và tên nguyên tố R
-Cho biết công thức hợp chất T tạo từ R và X
ion x- có tổng số hạt là 29 .Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 9
a)Xác định số hạt e,nowtron va số khối của X
b)Viết cấu hình e của X và ion X-
c)Nguyên tử nguyên tố R có cấu hình e lớp vỏ ngoài cùng 3s2
-Cho biết vị trí(chu kì,nhóm) và tên nguyên tố R
-Cho biết công thức hợp chất T tạo từ R và X
Cho biết nguyên tử Clo có Z17, cấu hình electron của ion Cl- là: A. 1s2 2s2 2p6 3s2 3p5 B. 1s2 2s2 2p6 3s2 3p6 C. 1s2 2s2 2p6 3s2 3p4 D. 1s2 2s2 2p6 3s2 3p6 4s1
Đọc tiếp
Cho biết nguyên tử Clo có Z=17, cấu hình electron của ion Cl- là:
A. 1s2 2s2 2p6 3s2 3p5
B. 1s2 2s2 2p6 3s2 3p6
C. 1s2 2s2 2p6 3s2 3p4
D. 1s2 2s2 2p6 3s2 3p6 4s1
Đáp án B
Theo quy tắc bát tử, Clo có xu hướng nhận thêm 1e
Đúng 0
Bình luận (0)
Cho ngtử K(Z=19) a) viết cấu hình electron nguyên tử và biểu diễn cấu hình theo ô orbital của nguyên tử Cl b)hãy cho biết Cl là nguyên tố s,p hay d?giải thích
Viết cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố thuộc . nhóm VIIA : flo (F), clo (Cl), brom (Br), iot (I), atatin (At).
Hãy cho biết đặc điểm về cấu hình electron lớp ngoài cùng của các nguyên tử trên và từ đó cho biết đặc điểm về tính chất của các nguyên tố tương ứng.
F: 2 s 2 2 p 5 ; Cl: 3 s 2 3 p 5 ; Br: 4 s 2 4 p 5 ; I: 5 s 2 5 p 5 ; At: 6 s 2 6 p 5
Nguyên tử của các nguyên tố thuộc nhóm VIIA có 7 electron ở lớp ngoài cùng với cấu hình ns 2 np 5
Vì chỉ kém khí hiếm đứng sau 1 electron nên trong các phản ứng hoá học, các nguyên tử có khuynh hướng thu thêm 1 electron để đạt được cấu hình vững bền của các khí hiếm đứng sau. Do đó, trong các hợp chất với nguyên tố kim loại, các nguyên tố thuộc nhóm VIIA có hoá trị 1.
Đúng 0
Bình luận (0)










