Phi kim X tạo ra cái HX. Phân tử khối của cái là 36,5. X là nguyên tố nào

Những câu hỏi liên quan
Câu 9:Nguyên tử của nguyên tố X có phân lớp ngoài cùng là 3p1. Nguyên tử của nguyên tố Y có phân lớp ngoàicùng là 4s. Điều khẳng định nào sau đây đúng?A.X, Y là kim loạiB.X là khí hiếm,Y là phi kimC.X là kim loại,Y là khí hiếm D.X là phi kim,Y là kim loạiCâu 10: Chọn câu đúng khi nói về nguyên tử trong các câu sau.A.Mg có 12 electronB.Mg có 24 protonC.Mg có 24 electronD.Mg có 24 nơtronCâu 11: Nguyên tử nào sau đây có số electron lớp ngoài cùng nhiều nhấtA. Ne (Z10)B. O (Z8)C. N (Z7)D. Cl (Z17)12...
Đọc tiếp
| Câu 9:Nguyên tử của nguyên tố X có phân lớp ngoài cùng là 3p1. Nguyên tử của nguyên tố Y có phân lớp ngoài | |||
| cùng là 4s. Điều khẳng định nào sau đây đúng? | |||
| A.X, Y là kim loại | B.X là khí hiếm,Y là phi kim | C.X là kim loại,Y là khí hiếm D.X là phi kim,Y là kim loại | |
| Câu 10: Chọn câu đúng khi nói về nguyên tử trong các câu sau. | |||
| A.Mg có 12 electron | B.Mg có 24 proton | C.Mg có 24 electron | D.Mg có 24 nơtron |
| Câu 11: Nguyên tử nào sau đây có số electron lớp ngoài cùng nhiều nhất | |||
| A. Ne (Z=10) | B. O (Z=8) | C. N (Z=7) | D. Cl (Z=17) |
12 24Mg Câu 12: Nguyên tử của nguyên tố X có phân lớp electron ngoài cùng là 3p4. Phát biểu nào sau đây không đúng?
A. X có 4 electron ở lớp ngoài cùng. B. X là phi kim.
C. X có 3 lớp electron. D. Số hạt mang điện của nguyên tử X là 32.
Câu 13: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là ?
A. 3 và 3 B. 3 và 4 C. 4 và 4 D. 4 và 3
Câu 14: Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 3e. Vậy số hiệu nguyên tử của nguyên tố R là:
A. 3 B. 15 C. 14 D. 13
Câu 15: Nguyên tử của nguyên tố nào sau đây khi nhận thêm 1e thì đạt cấu hình e của Ne(Z=10).
A. Cl(Z=17) B. F(Z=9) C. N(Z=7) D. Na(Z=11)
Câu 16: Cho các phát biểu sau:
(I) F là phi kim mạnh nhất.
(II) Li là KL có độ âm điện lớn nhất
(III) He là nguyên tử có bán kính nhỏ nhất.
(IV) Be là KL yếu nhất trong nhóm IIA.
Số các phát biểu đúng là?
A. 1 B. 2 C. 3 D. 4
Câu 17: Tính kim loại tăng dần trong dãy :
A. Ca, K, Al, Mg B. Al, Mg, Ca, K C. K, Mg, Al, Ca D. Al, Mg, K, Ca
Câu 18: Tính phi kim giảm dần trong dãy :
A. C, O, Si, N B. Si, C, O, N C. O, N, C, Si D. C, Si, N, O
Câu 19: Trong 1 nhóm A, bán kính nguyên tử của các nguyên tố:
A. Tăng theo chiều tăng dần của các điện tích hạt nhân. B. Giảm theo chiều tăng dần của các điện tích hạt nhân.
C. Giảm theo chiều tăng của tính kim loại. D. B và C đều đúng.
Câu 20 : Trong bảng tuần hoàn, nguyên tố X có số thứ 16, nguyên tố X thuộc :
A. Chu kì 3, nhóm IVA B. Chu kì 4, nhóm VIA. C. Chu kì 3, nhóm VIA D. Chu kì 4, nhóm IIIA.
Câu 21: Nguyên tử X có ký hiệu 2656X. Cho các phát biểu sau về X:
(1) Nguyên tử của nguyên tố X có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố X có 30 nơtron trong hạt nhân.
(3) X là một phi kim.
(4) X là nguyên tố d.
Trong các phát biểu trên, những phát biểu đúng là?
A. (1), (2), (3) và (4). B. (1), (2) và (4). C. (2) và (4). D. (2), (3) và (4).
Câu 22: Các nguyên tố cùng chu kỳ thì các nguyên tử của chúng có đặc điểm chung:
A. Cùng số lớp electron. B. Cùng số hiệu nguyên tử.
C. Cùng số electron hoá trị . D. Cùng số nơtron trong hạt nhân .
Câu 23: Các nguyên tố cùng trong một nhóm thì các nguyên tử của chúng có đặc điểm chung:
A. Cùng số lớp Electron. B. Cùng số Electron hoá trị.
C. Cùng số Electron ngoài lớp vỏ. D. Cùng điện tích hạt nhân.
Câu 24: Độ âm điện của nguyên tử của nguyên tố càng lớn thì:
A. Tính phi kim càng mạnh. B. Tính phi kim càng giảm
C. Tính kim loại càng mạnh D. Không ảnh hưởng đến tính chất của nguyên tố
Câu 25: Cho các kí hiệu 11 23 Na; 12 24 Mg;13 27 Al ; 19 39 K. Tính kim loại được xếp theo chiều tăng dần:
A. Na < Mg < Al < K. B. Al < Mg < Na < K. C. Na < Mg < K < Al. D. Al < K < Mg < Na.
Câu 26: Tính Bazơ của các hợp chất hiđrôxít của các nguyên tố Na, Mg, Al xếp theo chiều giảm dần là:
A. NaOH, Al(OH)3, Mg(OH)2. B. Al(OH)3, Mg(OH)2, NaOH
C. Mg(OH)2, Al(OH)3, NaOH D. NaOH, Mg(OH)2, Al(OH)3,
Câu 27: Các hạt cấu tạo nên nguyên tử của hầu hết các nguyên tố là
A. proton, nơtron. B. electron, proton.
C. nơtron, electron. D. electron, nơtron, proton.
Câu 28: Cho cấu hình electron của Mn (Z = 25): 1s22s22p63s23p63d54s2 . Hỏi Mn thuộc loại nguyên tố gì?
A. Nguyên tố s. B. Nguyên tố d. C. Nguyên tố f. D. Nguyên tố p.
Câu 29: Nguyên tử của nguyên tố A có tổng số electron ở các phân lớp p là 9. Nguyên tố A là
A. 15P. B. 17Cl. C. 14Si. D. 16S.
Câu 30: Có các đồng vị sau 1H
1 ; 12H ; 17 35Cl ; 17 37Cl . Có thể tạo ra số phân tử hiđroclorua HCl là
R có nguyên tử khối bằng 0.5 lần nguyên tử khối của silic
a) R là nguyên tố nào? Nó là nguyên tố kim loại hay phi kim?
b) R tạo nên đơn chất nào ? Viết công thức hóa học
Ta có :
Nguyên tử khối của Silic là 28 đvC
=> Nguyên tử khối của nguyên tố R là :
28 * 0,5 = 14 (đvC)
=> R là nguyên tố Nitơ
b) Khí Nitơ được tạo nên từ đơn chất N .
Có công thức hóa học là N2
Đúng 0
Bình luận (0)
a)R là nguyên tố Nitơ. Nó là nguyên tố phi kim (axit).
b)R tạo nên đơn chất Nitrat. Công thức hóa học: NO3
Đúng 0
Bình luận (0)
Hai nguyên tử X kết hợp với một nguyên tử oxi tạo ra phân tử oxit. Trong phân tử, nguyên tố oxi chiếm 25,8% khối lượng. Hỏi nguyên tố X là nguyên tố nào?
Gọi CTHH là X2O ta có:
%O= 16/2X+16.100%=25,8%
suy ra: 16/2X+16=0,258
Từ đó giải ra ta có X~ 23.
Vậy X là Na
Đúng 0
Bình luận (2)
- Gọi CTHH là X20
%0= 100% - 25,8% = 74,2 %
- Tỉ lệ :
74,2 / 2X = 25,8 / 16
<=> X = 74,2 * 16 / 25,8*2
<=> X = 23
Nguyên tố cần tìm là Natri ( Na)
vậy CTHH là Na20
Đúng 1
Bình luận (1)
Hợp chất A được hình thành từ ion X+ và Y-. Phân tử A chứa 9 nguyên tử gồm 3 nguyên tố phi kim. Biết tỉ lệ nguyên tử của mỗi nguyên tố là 2:3:4. Tổng só proton trong A là 42 và trong Y- chứa 2 nguyên tố phi kim cùng chu kì và thuộc 2 phân nhóm chính liên tiếp. Khi nói về A phát biểu nào sau đây không đúng A. Phân tử khối của A là 1 số chia hết cho 5 B. Trong A chỉ chứa liên kết ion và liên kết cộng hóa trị C. Trong các phản ứng hóa học hợp chất A vừa thể hiện tính khử vừa thể hiện tính oxi hóa...
Đọc tiếp
Hợp chất A được hình thành từ ion X+ và Y-. Phân tử A chứa 9 nguyên tử gồm 3 nguyên tố phi kim. Biết tỉ lệ nguyên tử của mỗi nguyên tố là 2:3:4. Tổng só proton trong A là 42 và trong Y- chứa 2 nguyên tố phi kim cùng chu kì và thuộc 2 phân nhóm chính liên tiếp. Khi nói về A phát biểu nào sau đây không đúng
A. Phân tử khối của A là 1 số chia hết cho 5
B. Trong A chỉ chứa liên kết ion và liên kết cộng hóa trị
C. Trong các phản ứng hóa học hợp chất A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
D. Hợp chất A kém bền với nhiệt khu đun nóng A bị nhiệt phân cho ra khí
Đáp án B
Ta có ![]()
Phải có một phi kim có ![]()
Do đó nguyên tố này chỉ có thể là H
Hai phi kim còn lại thuộc cùng 1 chu kì và thuộc 2 phân nhóm chính liên tiếp.
Gọi số proton của 2 nguyên tố đó lần lượt là Z và Z + 1
TH1: A có 2 nguyên tử H
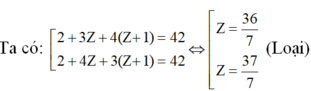
TH2: A có 3 nguyên tử H:
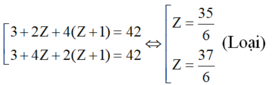
TH3: A có 4 nguyên tử H:
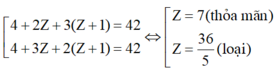
⇒ Hai nguyên tố còn lại là N (Z = 7) và O (Z = 8)
⇒ Công thức phân tử của A là: N2H4O3 hay NH4NO3
Nhận xét các đáp án:
A đúng: phân tử khối của A là 80 chia hết cho 5.
B sai: Trong phân tử A chứa liên kết ion liên kết cộng hóa trị và liên kết cho nhận
C đúng: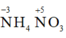 nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
D đúng: 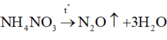
Đúng 0
Bình luận (0)
Hợp chất A được hình thành từ ion X+ và Y-. Phân tử A chứa 9 nguyên tử gồm 3 nguyên tố phi kim. Biết tỉ lệ nguyên tử của mỗi nguyên tố là 2:3:4. Tổng só proton trong A là 42 và trong Y- chứa 2 nguyên tố phi kim cùng chu kì và thuộc 2 phân nhóm chính liên tiếp. Khi nói về A phát biểu nào sau đây không đúng A. Phân tử khối của A là 1 số chia hết cho 5 B. Trong A chỉ chứa liên kết ion và liên kết cộng hóa trị C. Trong các phản ứng hóa học hợp chất A vừa thể hiện tính khử vừa thể hiện tính oxi hóa...
Đọc tiếp
Hợp chất A được hình thành từ ion X+ và Y-. Phân tử A chứa 9 nguyên tử gồm 3 nguyên tố phi kim. Biết tỉ lệ nguyên tử của mỗi nguyên tố là 2:3:4. Tổng só proton trong A là 42 và trong Y- chứa 2 nguyên tố phi kim cùng chu kì và thuộc 2 phân nhóm chính liên tiếp. Khi nói về A phát biểu nào sau đây không đúng
A. Phân tử khối của A là 1 số chia hết cho 5
B. Trong A chỉ chứa liên kết ion và liên kết cộng hóa trị
C. Trong các phản ứng hóa học hợp chất A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
D. Hợp chất A kém bền với nhiệt khu đun nóng A bị nhiệt phân cho ra khí
Đáp án B
Ta có  => Phải có một phi kim có Z
≤
4
=> Phải có một phi kim có Z
≤
4
Do đó nguyên tố này chỉ có thể là H
Hai phi kim còn lại thuộc cùng 1 chu kì và thuộc 2 phân nhóm chính liên tiếp.
Gọi số proton của 2 nguyên tố đó lần lượt là Z và Z + 1
TH1: A có 2 nguyên tử H
Ta có:
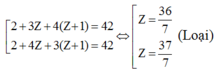
TH2: A có 3 nguyên tử H:
Ta có:
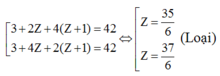
TH3: A có 4 nguyên tử H:
Ta có:
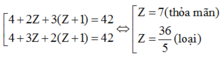
Hai nguyên tố còn lại là N (Z = 7) và O (Z = 8)
Công thức phân tử của A là: N2H4O3 hay NH4NO3
Nhận xét các đáp án:
A đúng: phân tử khối của A là 80 chia hết cho 5.
B sai: Trong phân tử A chứa liên kết ion liên kết cộng hóa trị và liên kết cho nhận
C đúng: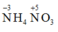 nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
D đúng: 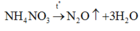
Đúng 0
Bình luận (0)
Câu 2: Cấu hình electron của nguyên tử nguyên tố X có dạng [Ne]3s23p3. Phát biểu nào sau đây là sai?
A. X ở ô số 15 trong bảng tuần hoàn.
B. X là một phi kim.
C. Nguyên tử của nguyên tố X có 9 electron p.
D. Nguyên tử của nguyên tố X có 3 phân lớp electron.
Cấm cọp
Mạng
TL:
Cấu hình electron đầy đủ của X: 1s22s22p63s23p31s22s22p63s23p3
→ X ở ô thứ 15 (z = 15), X là một phi kim (do có 5 electron lớp ngoài cùng), nguyên tử X có 9 electron p (6e trên phân lớp 2p; 3e trên phân lớp 3p)
→ Nguyên tử của nguyên tố X có 5 phân lớp: 1s, 2s, 2p, 3s, 3p.
( mk ko chép mạng nhé )
HT
Nguyên tố R là một phi kim, tỉ lệ phần trăm khối lượng của R trong hợp chất khí với hidro bằng 0,5955. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng hết với đơn chất R thì được 40,05 gam muối. Phân tử khối của muối tạo ra là A. 267 B. 169 C. 89 D. 107
Đọc tiếp
Nguyên tố R là một phi kim, tỉ lệ phần trăm khối lượng của R trong hợp chất khí với hidro bằng 0,5955. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng hết với đơn chất R thì được 40,05 gam muối. Phân tử khối của muối tạo ra là
A. 267
B. 169
C. 89
D. 107
Đáp án A
* Xác định nguyên tố phi kim R:
+) Nếu hóa trị của R trong oxit cao nhất là chẵn thì ta có công thức của oxit cao nhất là ROn.
Khi đó công thức của hợp chất khí với hidro của R là RH8-2n. Theo giả thiết đề bài ta có:

| n |
1 |
2 |
3 |
| R |
8,72 |
37,22 |
65,72 |
Do đó trường hợp này có kết quả thỏa mãn.
+) Nếu hóa trị của R trong oxit cao nhất là lẻ thì ta có công thức oxit cao nhất là R2On.
Khi đó công thức của hợp chất khí với hidro của R là RH8-n. Theo giả thiết đề bài ta có:
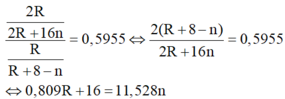
| n |
1 |
3 |
5 |
7 |
| R |
âm |
22,97 |
51,47 |
80 |
Do đó có n = 7 và R = 80 thỏa mãn.
Suy ra R là Br.
* Xác định kim loại M.
Vì Br trong hợp chất muối với kim loại có hóa trị I
Nên gọi công thức của muối thu được là MBrx với x là hóa trị của M. Theo định luật bảo toàn khối lượng ta có:
![]() (gam)
(gam)
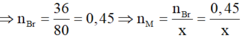
Mà 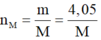 nên
nên 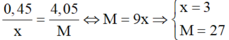 là Al.
là Al.
Do đó muối thu được là AlBr3.
Vậy phân tử khối của muối tạo ra là 27 + 80.3 = 267
Đúng 0
Bình luận (0)
Nguyên tố R là một phi kim, tỉ lệ phần trăm khối lượng của R trong hợp chất khí với hidro bằng 0,5955. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng hết với đơn chất R thì được 40,05 gam muối. Phân tử khối của muối tạo ra là A. 267 B. 169 C. 89 D. 107
Đọc tiếp
Nguyên tố R là một phi kim, tỉ lệ phần trăm khối lượng của R trong hợp chất khí với hidro bằng 0,5955. Cho 4,05 gam một kim loại M chưa rõ hóa trị tác dụng hết với đơn chất R thì được 40,05 gam muối. Phân tử khối của muối tạo ra là
A. 267
B. 169
C. 89
D. 107
Đáp án A
* Xác định nguyên tố phi kim R:
+) Nếu hóa trị của R trong oxit cao nhất là chẵn thì ta có công thức của oxit cao nhất là ROn.
Khi đó công thức của hợp chất khí với hidro của R là RH8-2n. Theo giả thiết đề bài ta có:

Do đó trường hợp này có kết quả thỏa mãn.
+) Nếu hóa trị của R trong oxit cao nhất là lẻ thì ta có công thức oxit cao nhất là R2On.
Khi đó công thức của hợp chất khí với hidro của R là RH8-n. Theo giả thiết đề bài ta có:

Do đó có n = 7 và R = 80 thỏa mãn.
Suy ra R là Br.
* Xác định kim loại M.
Vì Br trong hợp chất muối với kim loại có hóa trị I
Nên gọi công thức của muối thu được là MBrx với x là hóa trị của M. Theo định luật bảo toàn khối lượng ta có:
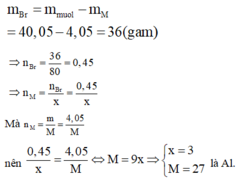
Do đó muối thu được là AlBr3.
Vậy phân tử khối của muối tạo ra là 27 + 80.3 = 267
Đúng 0
Bình luận (0)
Một hyđroxyt có công thức hóa học là M(OH)2, biết phân tử khối của hiđroxyt là 90 đvC. Hãy xác định tên nguyên tố M ? Cho biết nguyên tố M là kim loại hay phi kim ?
làm dưới dạng tìm X mong mn giúp
Nguyên tử khối của M:
90 - 17.2 = 56 (đvC)
--> M là sắt (Fe)
M là kim loại
Đúng 2
Bình luận (0)















