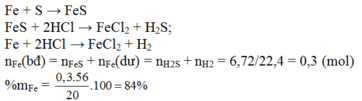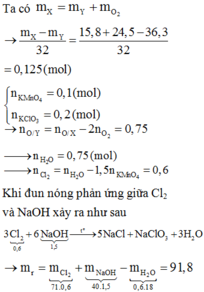đun nóng 6,8 g hỗn hợp rắn X gồm Fe và Mg cần dùng đựng khí clo đúng bằng lượng khí clo sinh ra khi đun nóng 17,4 gam MNO2 với dung dịch HCl đặc dư thành phần phần trăm khối lượng fe có trong hỗn hợp X

Những câu hỏi liên quan
Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là:
A. 28%
B. 56%
C. 42%
D. 84%
Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là
A. 28%
B. 56%
C. 42%
D. 84%
Đun nóng 48,2gam hỗn hợp X gồm KMnO4 và KClO3 sau một thời gian thu được 43,4gam hỗn hợp chất rắn Y. Cho Y tác dụng hoàn toàn với dung dịch HCl đặc, đun nóng, sau phản ứng thu được 15,12 lít khí clo (đktc) và dd Z gồm các chất tan MnCl2, KCl, HCl dư. Tính thành phần % về khối lượng của các chất trong hỗn hợp X.
Gọi số mol KMnO4 và KClO3 trong hỗn hợp ban đầu lần lượt là x,y
158x + 122,5y= 48,2 (1)
Bảo toàn elcton toàn quá trình ta có
Mn+7+5e →Mn+2
x 5x
Cl+5 + 6e → Cl–1
y 6y
(về bản chất có 1 phần Cl+5 có 1 phần chuyển sang Cl0, nhưng Cl–1 lại nhường e tạo Cl0 vì vậy để đơn giản ta có thể coi tất cả Cl+5 tạo thành Cl–1)
2Cl–1→ Cl2 +2e
0,675 0,135
2O–2 → O2 + 4e
0,15 0,6
Áp dụng định luật bảo toàn e ta có 5x+6y=1,95 (2)
Từ 1 và 2 ta có hệ phương trình
Giải ta được x=0,15 và y=0,2
% mKMnO4 = 49,17 % và % mKClO3 =50,83%
Đúng 0
Bình luận (0)
Nung nóng hỗn hợp X gồm 15,8 gam KMnO4 và 24,5 gam KClO3 một thời gian thu được 36,3 gam hỗn hợp Y gồm 6 chất. Cho Y tác dụng với dung dịch HCl đặc dư đun nóng lượng khí clo sinh ra cho hấp thụ vào 300 ml dung dịch NaOH 5M đun nóng thu được dung dịch Z. Cô cạn Z được chất rắn khan các phản ứng xảy ra hoàn toàn. Khối lượng chất rắn khan (gam) thu được là A. 111 B. 12 C. 79,8 D. 91,8
Đọc tiếp
Nung nóng hỗn hợp X gồm 15,8 gam KMnO4 và 24,5 gam KClO3 một thời gian thu được 36,3 gam hỗn hợp Y gồm 6 chất. Cho Y tác dụng với dung dịch HCl đặc dư đun nóng lượng khí clo sinh ra cho hấp thụ vào 300 ml dung dịch NaOH 5M đun nóng thu được dung dịch Z. Cô cạn Z được chất rắn khan các phản ứng xảy ra hoàn toàn. Khối lượng chất rắn khan (gam) thu được là
A. 111
B. 12
C. 79,8
D. 91,8
Nung nóng hỗn hợp gồm 15,8 gam KMnO4 và 24,5 gam KClO3 một thời gian thu được 36,3 gamhỗn hợp Y gồm 6 chất. Cho Y tác dụng với dung dịch HCl đặc dư đun nóng lượng khí clo sinh ra cho hấpthụ vào 300 ml dung dịch NaOH 5M đun nóng thu được dung dịch Z. Cô cạn Z được chất rắn khan cácphản ứng xảy ra hoàn toàn. Khối lượng chất rắn khan thu được là?
Em có thể tham khảo cách giải sau:
Ta có: mO2 = (15,8 + 24,5)-36,3 = 4 gam. => nO2 = 0,125 mol.
nKMnO4 = 0,1 mol, nKClO3 = 0,2 mol.
Mn7+ + 5e -> Mn2+
Cl5+ + 6e -> Cl-1
2O2- -> O2 + 4e
2Cl-1 -> Cl2 + 2e
Bảo toàn electron, ta có: 0,1*5 + 0,2*6 = 0,125*4 + 2*nCl2
=> nCl2 =0,6 mol.
3Cl2 + 6NaOH -> 5NaCl + NaClO3 + 3H2O (vì đun nóng).
Bđ 0,6 1,5
P/ư 0,6 1,2 1,0 0,2
Sau p/ư 0 0,3 1,0 0,2.
=> m Rắn =0,3*40 + 1,0*58,5 + 0,2*106,5 = 91,8 gam.
Đúng 0
Bình luận (0)
Đốt cháy hỗn hợp gồm 1,92 gam Mg và 4,48 gam Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120 ml dung dịch HCl 2M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, thu được 56,69 gam kết tủa. Phần trăm thể tích của clo trong hỗn hợp X là: A. 51,72% B. 76,70% C. 53,85% D. 56,36%
Đọc tiếp
Đốt cháy hỗn hợp gồm 1,92 gam Mg và 4,48 gam Fe với hỗn hợp khí X gồm clo và oxi, sau phản ứng chỉ thu được hỗn hợp Y gồm các oxit và muối clorua (không còn khí dư). Hòa tan Y bằng một lượng vừa đủ 120 ml dung dịch HCl 2M, thu được dung dịch Z. Cho AgNO3 dư vào dung dịch Z, thu được 56,69 gam kết tủa. Phần trăm thể tích của clo trong hỗn hợp X là:
A. 51,72%
B. 76,70%
C. 53,85%
D. 56,36%
Chọn C
nMg = 0,08 mol ; nFe = 0,08 mol
Khi phản ứng với X thì có x mol Cl2 và y mol O2 phản ứng
Giả sử tạo a mol Fe2+ và (0,08 – a) mol Fe3+
Bảo toàn điện tích : 2.0,08 + 2a + 3(0,08 – a) = 2x + 4y
Hòa tan Y bằng HCl : 2Cl thay thế 1 O => nO = ½ nHCl = 0,12 mol = 2y
=> 0,4 – a = 2x + 4.0,06 (1)
,Sau đó : phản ứng với AgNO3 tạo : (2x + 0,24) mol AgCl và a mol Ag
=> 56,69 = 143,5(2x + 0,24) + 108a (2)
Từ (1),(2) => x = 0,07 ; a = 0,02 mol
=> %VCl2(X) = 53,85%
Đúng 0
Bình luận (0)
Cho 7,36 gam hỗn hợp X gồm Mg và Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng dư thu được 5,04 lít khí SO2 đktc (là sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Z được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 7,2 gam hỗn hợp rắn. Phần trăm khối lượng của Fe trong X là: A. 38,04% B. 83,7% C. 60,87% D. 49,46%
Đọc tiếp
Cho 7,36 gam hỗn hợp X gồm Mg và Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng dư thu được 5,04 lít khí SO2 đktc (là sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Z được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 7,2 gam hỗn hợp rắn. Phần trăm khối lượng của Fe trong X là:
A. 38,04%
B. 83,7%
C. 60,87%
D. 49,46%
Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%
Đúng 0
Bình luận (0)
Hỗn hợp X gồm Al , fe và Cu. chia a gam X thành 3 phần bằng nhau
- Phần 1 cho tác dụng vào lượng dư dung dịch HCl thì thu được 5,6 lit khí H2
- phần 2 hòa tan hoàn toàn bằng lượng dư dung dịch H2SO4 đặc đun nóng thì thu được 7,84 lít khí SO2 (sản phẩm khử duy nhất) ,dung dịch y và chất rắn Z. Cho y tác dụng với lượng dư dung dịch NaOH thu được kết tủa T. Lọc lấy T đem nung trong không khí đến khối lượng không đổi thì thu được 12 g rắn G
- phần 3 đốt cháy trong bình có chứa lượng dư khí Clo thu...
Đọc tiếp
Hỗn hợp X gồm Al , fe và Cu. chia a gam X thành 3 phần bằng nhau - Phần 1 cho tác dụng vào lượng dư dung dịch HCl thì thu được 5,6 lit khí H2 - phần 2 hòa tan hoàn toàn bằng lượng dư dung dịch H2SO4 đặc đun nóng thì thu được 7,84 lít khí SO2 (sản phẩm khử duy nhất) ,dung dịch y và chất rắn Z. Cho y tác dụng với lượng dư dung dịch NaOH thu được kết tủa T. Lọc lấy T đem nung trong không khí đến khối lượng không đổi thì thu được 12 g rắn G - phần 3 đốt cháy trong bình có chứa lượng dư khí Clo thu được b gam chất rắn E biết các phản ứng xảy ra hoàn toàn. Tính giá trị của a và b Làm hộ em với ạ!!!。゚( ゚^∀^゚)゚。
Cho 37,96 g hỗn hợp gồm MNO2 và KMnO4 tác dụng với dung dịch HCl đặc dư sau phản ứng thu được 10,08 lít khí Clo dktc và dung dịch A. a) Tính thành phần phần trăm theo khối lượng mỗi chất trong hỗn hợp ban đầu. b) Tính khối lượng của các muối có trong dung dịch A
Xem chi tiết
\(Đặt:n_{MnO_2}=a\left(mol\right),n_{KMnO_4}=b\left(mol\right)\)
\(m_{hh}=87a+158b=37.96\left(g\right)\left(1\right)\)
\(n_{Cl_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(MnO_2+4HCl\rightarrow MnCl_2+Cl_2+2H_2O\)
\(n_{Cl_2}=a+2.5b=0.45\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.4,b=0.02\)
\(\%MnO_2=\dfrac{0.4\cdot87}{37.96}\cdot100\%=91.68\%\\\%KMnO_4=100-91.68=8.32\% \)
\(m_M=m_{KCl}+m_{MnCl_2}=0.02\cdot74.5+\left(0.4+0.02\right)\cdot126=54.41g\)
Đúng 1
Bình luận (0)