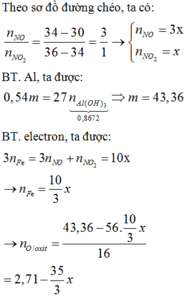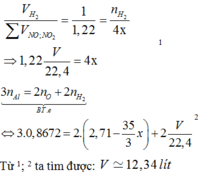Cho V lít khí H2 dư qua hỗn hợp X gồm CuP, Fe2O3 và MgO nung nóng, thu được m gam chất rắn Y và 13,44 lít hỗn hợp Z gồm khí và nước. Tỷ khối Z so với O2 là 0,2375. Tìm V và m

Những câu hỏi liên quan
Cho V lít khí H2 (dư) đi qua 28 g hỗn hợp X gồm CuO,Fe2O3,MgO nung nóng,thu được m gam chất rắn Y và 13,44 lít hỗn hợp Z.Tỉ khối của Z so với O2 là 0,2375.Tính V và m
Hỗn hợp khí là: \(H_2;H_20\)( hơi nước)
Gọi số mol (H2) = x và số mol (H2O ) = y
Ta có: \(x+y=\frac{13,44}{22,4}=0,6\)(1)
\(M_Z=0,2375.M_{O_2}=0,2375.32=7,6\)
<=> \(\frac{2x+18y}{x+y}=7,6\)
<=> 2x + 18 y = 7,6 . 0,6 = 4,56 (2)
Từ (1) và (2) => x = 0,39 và y = 0,21
\(n_{H_2\left(pứ\right)}=n_{H_2O}=0,21\left(mol\right)\)
=> \(m_{H_2\left(pư\right)}=2.0,21=0,42\left(g\right);m_{H_20}=0,21.18=3,78\left(g\right)\)
Theo bảo toàn khối lượng
=> \(m_{H_2\left(pứ\right)}+m_X=m_Y+m_{H_20}\)
=> \(m_Y=0,42+28-3,78=24,64\left(g\right)\)
Cho m gam hỗn hợp X gồm Fe2O3, CuO, MgO, FeO và Fe3O4 vào dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Mặt khác nung m gam hỗn hợp X với khí CO dư thu được chất rắn Y và hỗn hợp khí Z. Cho Z vào dung dịch Ca(OH)2 dư thu được 35 gam kết tủa. Cho chất rắn Y vào dung dịch HNO3 đặc, nóng, dư thu được V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của V là A. 11,2. B. 22,4. C. 44,8. D. 33,6.
Đọc tiếp
Cho m gam hỗn hợp X gồm Fe2O3, CuO, MgO, FeO và Fe3O4 vào dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Mặt khác nung m gam hỗn hợp X với khí CO dư thu được chất rắn Y và hỗn hợp khí Z. Cho Z vào dung dịch Ca(OH)2 dư thu được 35 gam kết tủa. Cho chất rắn Y vào dung dịch HNO3 đặc, nóng, dư thu được V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của V là
A. 11,2.
B. 22,4.
C. 44,8.
D. 33,6.
Cho m gam hỗn hợp X gồm Fe2O3, CuO, MgO, FeO và Fe3O4 vào dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Mặt khác nung m gam hỗn hợp X với khí CO dư thu được chất rắn Y và hỗn hợp khí Z. Cho Z vào dung dịch Ca(OH)2 dư thu được 35 gam kết tủa. Cho chất rắn Y vào dung dịch HNO3 đặc, nóng, dư thu được V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của V là A.11,2. B. 22,4. C. 44,8. D. 33.6.
Đọc tiếp
Cho m gam hỗn hợp X gồm Fe2O3, CuO, MgO, FeO và Fe3O4 vào dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Mặt khác nung m gam hỗn hợp X với khí CO dư thu được chất rắn Y và hỗn hợp khí Z. Cho Z vào dung dịch Ca(OH)2 dư thu được 35 gam kết tủa. Cho chất rắn Y vào dung dịch HNO3 đặc, nóng, dư thu được V lít khí NO2 (đktc) là sản phẩm khử duy nhất. Giá trị của V là
A.11,2.
B. 22,4.
C. 44,8.
D. 33.6.
Đáp án C
X + CO tạo thành chất rắn Y gồm các kim loại Mg, Fe, Cu và hỗn hợp khí z gồm CO2 và CO dư
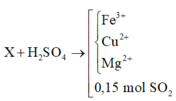
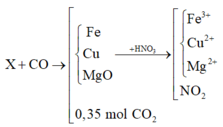
Áp dụng định luật bảo toàn mol electron
Trong thí nghiệm 1: ne nhường = ne nhận = 0,3(mol)
ne nhường trong thí nghiệm = ne nhường (1) + 2.nCO2 =1(mol) = ne nhận (2) = nNO2
Chú ý: Với các bài toán của phản ứng oxi hoá khử gồm nhiều quá trình ta thường sử dụng bảo toàn electron cho toàn bộ các quá trình, bỏ qua giai đoạn trung gian.
Đúng 0
Bình luận (0)
Cho V lít khí H2 (dư) đi qua 28g hỗn hợp X gồm CuO, Fe2O3 và MgO nung nóng, thu đc m gam chất rắn Y và 13,44 lít hỗn hợp Z(gồm chất khí và hơi). Tỉ khối của Z so với O2 là 0,2375. Tính V và m
\(13,44_Z\left\{{}\begin{matrix}H_2\\H_2O\end{matrix}\right.\)
Áp dụng phương pháp đường chéo :
\(\frac{7}{13}:\frac{H_2}{H_2O}\)
\(n_{H2O}=0,39\left(mol\right);n_{H2}=0,21\left(mol\right)\)
\(m_Y=28-0,12.16=24,64\left(g\right)\)
\(V_{H2}=0,21.22,4=4,704\left(l\right)\)
Dẫn V (đktc) lít hỗn hợp khí X chứa C2H2, C2H4, H2 có tỷ khối so với H2 là 4,7 qua Niken nung nóng thu được hỗn hợp khí Y. Dẫn hỗn hợp Y qua nước Br2 dư thấy khối lượng bình tăng 5,4 gam và thu được hỗn hợp khí Z. Đốt cháy hoàn toàn hỗn hợp khí Z thu được 4,48 lít khí CO2 (đktc) và 14,4 gam H2O. Giá trị V là A. 22,4 lit. B. 11,2 lit. C. 5,6 lit. D. 2,24 lit
Đọc tiếp
Dẫn V (đktc) lít hỗn hợp khí X chứa C2H2, C2H4, H2 có tỷ khối so với H2 là 4,7 qua Niken nung nóng thu được hỗn hợp khí Y. Dẫn hỗn hợp Y qua nước Br2 dư thấy khối lượng bình tăng 5,4 gam và thu được hỗn hợp khí Z. Đốt cháy hoàn toàn hỗn hợp khí Z thu được 4,48 lít khí CO2 (đktc) và 14,4 gam H2O. Giá trị V là
A. 22,4 lit.
B. 11,2 lit.
C. 5,6 lit.
D. 2,24 lit
Đáp án A
V lít hhX chứa C2H2, C2H4, H2 có dX/H2 = 4,7.
hhX qua Ni, to → hhY.
Dẫn Y qua Br2 dư → mbình tăng = 5,4 gam + hh khí Z.
hhZ + O2 → 0,2 mol CO2 + 0,8 mol H2O
• hh khí Z chỉ gồm hiđrocacbon và H2 dư nên
mZ = mC + mH = 0,2 x 12 + 0,8 x 2 = 4 gam.
Theo BTKL:
mX = mY = mbình tăng + mZ = 5,4 + 4 = 9,4 gam.
→ nX = 9,4 : 9,4 = 1 mol
→ VX = 1 x 22,4 = 22,4 lít
Đúng 0
Bình luận (0)
Dẫn 4,48 lít CO (đktc) đi qua m gam hỗn hợp oxit nung nóng gồm MgO, Al2O3, Fe2O3 và CuO. Sau một thời gian, thu được hỗn hợp rắn X và hỗn hợp khí Y có tỉ khối so với H2 là 20,4. Cho X tan hoàn toàn trong dung dịch HCl (loãng), thu được dung dịch Z chỉ chứa (2m – 4,36) gam muối và thoát ra 1,792 lít (đktc) khí H2. Cho Z tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được (5m + 9,08) gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây? A. 34. B. 35. C. 36. D. 37.
Đọc tiếp
Dẫn 4,48 lít CO (đktc) đi qua m gam hỗn hợp oxit nung nóng gồm MgO, Al2O3, Fe2O3 và CuO. Sau một thời gian, thu được hỗn hợp rắn X và hỗn hợp khí Y có tỉ khối so với H2 là 20,4. Cho X tan hoàn toàn trong dung dịch HCl (loãng), thu được dung dịch Z chỉ chứa (2m – 4,36) gam muối và thoát ra 1,792 lít (đktc) khí H2. Cho Z tác dụng hoàn toàn với dung dịch AgNO3 dư, thu được (5m + 9,08) gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
A. 34.
B. 35.
C. 36.
D. 37.
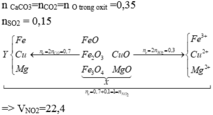
Hỗn hợp X gồm m gam các oxit sắt và 0,54m gam Al. Nung hỗn hợp X trong chân không cho đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp Y. Cho hỗn hợp Y tác dụng với dung dịch NaOH dư thu được V lít H2 (đktc); dung dịch Z và chất rắn T. Thổi khí CO2 dư vào dung dịch Z thu được 67,6416 gam kết tủa. Cho chất rắn T tác dụng với dung dịch HNO3 dư thu được 1,22V lít hỗn hợp khí gồm NO và NO2 (đktc) có tỉ khối so với H2 là 17. Giá trị của V là A. 11,25 B. 12,34 C. 13,32 D. 14,56
Đọc tiếp
Hỗn hợp X gồm m gam các oxit sắt và 0,54m gam Al. Nung hỗn hợp X trong chân không cho đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp Y. Cho hỗn hợp Y tác dụng với dung dịch NaOH dư thu được V lít H2 (đktc); dung dịch Z và chất rắn T. Thổi khí CO2 dư vào dung dịch Z thu được 67,6416 gam kết tủa. Cho chất rắn T tác dụng với dung dịch HNO3 dư thu được 1,22V lít hỗn hợp khí gồm NO và NO2 (đktc) có tỉ khối so với H2 là 17. Giá trị của V là
A. 11,25
B. 12,34
C. 13,32
D. 14,56
Cho m gam hỗn hợp X gồm Fe2O3; CuO; MgO; FeO; Fe3O4 vào dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Mặt khác nung nóng 2m gam hỗn hợp X với khí CO dư thu được chất rắn Y và hỗn hợp khí Z. Cho Zvào dung dịch Ca(OH)2dư thu được 70 g kết tủa. Cho chất rắn Y vào dung dịch HNO3 đặc nóng, dư thu được V1 khí NO2 (là sản phẩm khử duy nhất ở đktc). Giá trị của V là: A.44,8 lít B.22,4 lít C.17,92 lít D.89,6 lít
Đọc tiếp
Cho m gam hỗn hợp X gồm Fe2O3; CuO; MgO; FeO; Fe3O4 vào dung dịch H2SO4 đặc nóng thu được 3,36 lít khí SO2 (đktc). Mặt khác nung nóng 2m gam hỗn hợp X với khí CO dư thu được chất rắn Y và hỗn hợp khí Z. Cho Zvào dung dịch Ca(OH)2dư thu được 70 g kết tủa. Cho chất rắn Y vào dung dịch HNO3 đặc nóng, dư thu được V1 khí NO2 (là sản phẩm khử duy nhất ở đktc). Giá trị của V là:
A.44,8 lít
B.22,4 lít
C.17,92 lít
D.89,6 lít
Đáp án B:
Số oxi hóa thấp nhất ![]() Số oxi hóa cao nhất(B)
Số oxi hóa cao nhất(B)
Với m gam X + H2SO4 (đặc nóng)
Bảo toàn e ta có ne cho = ne nhận= = 0,3(mol)
Với 2m gam X phản ứng với CO
=>Bảo toàn electron ta có:
ne cho = ne nhận= =0,14(mol)
=>Với m gam X phản ứng với CO có
ne nhận=0,7(mol)
![]()
=>Trong 2m gam X tạo 2 mol NO2
Đúng 0
Bình luận (0)
bài 1: Hỗn hợp X gồm: CuO, FeO, và Fe3O4. Dẫn V lít khí CO dư (đktc) đi qua ống đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm, thu được 54 gam chất rắn Y trong ống sứ và 11,2 lít hỗn hợp khí A (đktc) có tỉ khối hơi so với H2 là 20,4.a/Viết PTHH.b/ Tính khối lượng mỗi khí trong hỗn hợp A.c/ Tính V, m.bài 2: Đốt cháy hoàn toàn 44,8 gam hỗn hợp gồm FeS và FeS2 trong V lít không khí (đktc) vừa đủ (không khí có 20% thể tích là O2, 80% thể tích là N2), thu được m gam Fe2O3 và V’ lít hỗn...
Đọc tiếp
bài 1: Hỗn hợp X gồm: CuO, FeO, và Fe3O4. Dẫn V lít khí CO dư (đktc) đi qua ống đựng m gam hỗn hợp X nung nóng. Sau khi kết thúc thí nghiệm, thu được 54 gam chất rắn Y trong ống sứ và 11,2 lít hỗn hợp khí A (đktc) có tỉ khối hơi so với H2 là 20,4.
a/Viết PTHH.
b/ Tính khối lượng mỗi khí trong hỗn hợp A.
c/ Tính V, m.
bài 2: Đốt cháy hoàn toàn 44,8 gam hỗn hợp gồm FeS và FeS2 trong V lít không khí (đktc) vừa đủ (không khí có 20% thể tích là O2, 80% thể tích là N2), thu được m gam Fe2O3 và V’ lít hỗn hợp khí (đktc) gồm N2 và SO2, trong đó SO2 chiếm 14,89% về thể tích.
a/ Viết PTHH.
b/ Tìm V.
c/ Tính khối lượng từng chất trong hỗn hợp đầu.
d/ Tìm m.
bài 3: Cacnalit là một loại muối có công thức là KCl.MgCl2.xH2O. Nung 33,3 gam muối đó tới khối lượng không đổi thì thu được 20,34 g muối khan.
a/ Tìm x.
b/ Tính số nguyên tử clo có trong 33,3 gam cacnalit.