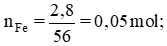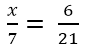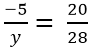Giải bài 4 trang 84 sgk hóa 8

Những câu hỏi liên quan
giải hộ bài 11 trang 84 sgk toán 6 tập hai /sách bài tập
bài 8 sgk trang 101 môn hóa lớp 8
Bài 4*,5* sgk hóa 8 trang 84
4.a)
nP=\(\dfrac{12,4}{31}\) 0,4 (mol).
n\(_{O_2}\)=\(\dfrac{17}{32}\)= 0,53 (mol).
PTHH :
4P + 5O2 → 2P2O5
0,4 0,5 0,2 (mol)
Vậy số mol oxi còn thừa lại là :
0,53 – 0,5 = 0,03 (mol).
4.b) Chất được tạo thành là P2O5 . Theo PTHH, ta có :
n\(_{P_2O_5}\)=\(\dfrac{1}{2}\)nP=12.0,4=0,2 (mol).
⇒m\(_{P_2O_5}\) = 0,2.(31.2 + 16.5) = 28,4(g)
Đúng 0
Bình luận (0)
5)PTHH:
C + O2 → CO2
12g 22,4(lít)
Khối lượng tạp chất lưu huỳnh và tạp chất khác là :
24. (0,5% + 1,5%) = 0,48kg = 480g.
Khối lượng cacbon nguyên chất là : 24 – 0,48 = 23,52 (kg) = 23520 (g).
Theo phương trình phản ứng, thể tích CO2 tạo thành là :
V\(_{CO_2}\)=\(\dfrac{23520}{12}\).22,4= 43904 (lít).
Phương trình phản ứng cháy của lưu huỳnh :
S + O2 → SO2
Khối lượng tạp chất lưu huỳnh là : 24.0,5% = 0,12 kg = 120 (g)
Theo phương trình phản ứng, thể tích khí SO2 tạo thành là :
V\(_{SO_2}\)=\(\dfrac{120}{32}.22,4\)=84 (l).
Đúng 0
Bình luận (3)
Bài 1,2 trang 75 sgk hóa 8
Mong mn gúp mình làm bài với
Bài 1:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: nH2 = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: VH2= 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài 2:
a) Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
Số mol của S tham gia phản ứng:
nS = 16/32 = 0,05 mol
Theo phương trình hóa học, ta có: nSO2 = nS = nO2 = 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2= 22,4 . 0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4 . 0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
=> Vkk = 5 VO2 = 5 . 1,12 = 5,6 lít
Đúng 0
Bình luận (0)
Bài 1 :
Phương trình hóa học: Fe + 2HCl → FeCl2 + H2.
Số mol sắt tham gia phản ứng là: 1,6321,632 = 0,05 mol
- Theo phương trình hóa học, ta có: nSO2nSO2 = nS = 0,05 mol
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2VSO2 = 22,4 . 0,05 = 1,12 (lít)
- Theo phương trình hóa học, ta có: nO2nO2 = nS = 0,05 mol
Thể tích khí oxi cần dùng ở đktc là:
VO2VO2 = 22,4 . 0,05 = 1,12 (lít)
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần dùng ở đktc là:
Vkk = 5VO2VO2 = 5 . 1,12 = 5,6 (lít)
Đúng 0
Bình luận (0)
Bài 1 :
a) PTPU
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (lít)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)
Bài 2 :
a) Phương trình hóa học của S cháy trong không khí:
S + O2 to→→to SO2
b) Số mol của S tham gia phản ứng:
nS = 1,6321,632 = 0,05 mol
- Theo phương trình hóa học, ta có: nSO2nSO2 = nS = 0,05 mol
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2VSO2 = 22,4 . 0,05 = 1,12 (lít)
- Theo phương trình hóa học, ta có: nO2nO2 = nS = 0,05 mol
Thể tích khí oxi cần dùng ở đktc là:
VO2VO2 = 22,4 . 0,05 = 1,12 (lít)
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần dùng ở đktc là:
Vkk = 5VO2VO2 = 5 . 1,12 = 5,6 (lít)
Đúng 0
Bình luận (0)
giải theo đúng 1 bài tìm x cho mik nha
Ví dụ 2x+7-5= 28
=> 2x+7=28-5
=>2x+7=23
=>2x =23-7
=>2x =16
=>x =16:2
=> x =8
Đúng 3
Bình luận (0)
a) x/7=6/21
x.21=6.7
x.21=42
x=42:21
x=2
b) -5/y=20/28
y.20=(-5).28
y.20= -140
y= (-140):20
y= -7
TICK CHO MÌNH NHA^^
Đúng 1
Bình luận (0)
Ví dụ 2x+7-5= 28
=> 2x+7=28-5
=>2x+7=23
=>2x =23-7
=>2x =16
=>x =16:2
=> x =8
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Bài 3 (SGK trang 84 ) : Butan có công thức phân tử là C4H10 , khi cháy tạo khí cacnobic và hơi nước , đồng thời tỏa nhiều nhiệt. Viết phương trình hóa học biểu diễn sự cháy của butan.
PTHH: \(2C_4H_{10}+13O_2\underrightarrow{t^o}8CO_2+10H_2O\)
Đúng 2
Bình luận (0)
2 SGK VNEN trang 84(bài 2 phần D)
Bài 4(SGK trang 125). Hãy cho biết chất nào trong số các chất sau đây có thể làm mất màu dung dịch nước brom. Giải thích và viết phương trình hóa học(nếu có).
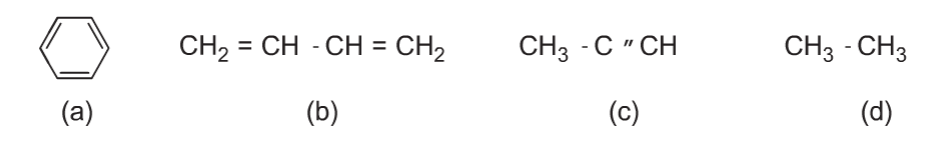
Chỉ có chất b và c làm mất màu dung dịch brom vì trong phân tử có liên kết đôi và liên kết ba tương tự etilen, axetilen.
Các phương trình phản ứng hóa học:
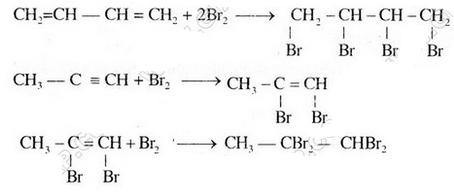
Đúng 1
Bình luận (0)
Giả sử 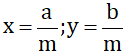
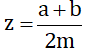
Xem thêm câu trả lời









 hai trang cuối là câu 5
hai trang cuối là câu 5