Đốt hỗn hợp 8,4g Fe và 3,2g S trong bình kín đến khi kết thúc pứ. Sản phẩm thu được cho pứ vs dung dịch HCl dư. Tính thể tích không khí thu được ở đktc

Những câu hỏi liên quan
Cho hỗn hợp X gồm (Mg, Al, Fe, Cu) trong đó có Mg và Fe có số mol bằng nhau. Lấy 7,5 gam hỗn hợp X cho vào cốc đựng dung dịch HCl dư, sau phản ứng thu được 5,152 lít khí (đktc) và hỗn hợp sản phẩm (gồm cả dung dịch và phần không tan). Cho từ từ một lượng vừa đủ Mg(NO3)2 vào hỗn hợp sản phẩm đến khi kết thúc các phản ứng thu được V lít (đktc) một khí không màu, hóa nâu trong không khí (không còn sản phẩm khử khác) và dung dịch Y. Cho NaOH dư vào Y thu được 9,92 gam hỗn hợp chất kết tủa khan. % kh...
Đọc tiếp
Cho hỗn hợp X gồm (Mg, Al, Fe, Cu) trong đó có Mg và Fe có số mol bằng nhau. Lấy 7,5 gam hỗn hợp X cho vào cốc đựng dung dịch HCl dư, sau phản ứng thu được 5,152 lít khí (đktc) và hỗn hợp sản phẩm (gồm cả dung dịch và phần không tan). Cho từ từ một lượng vừa đủ Mg(NO3)2 vào hỗn hợp sản phẩm đến khi kết thúc các phản ứng thu được V lít (đktc) một khí không màu, hóa nâu trong không khí (không còn sản phẩm khử khác) và dung dịch Y. Cho NaOH dư vào Y thu được 9,92 gam hỗn hợp chất kết tủa khan. % khối lượng của Fe gần với giá trị nào sau đây nhất? (Mg=24, Al=27, Fe=56, Cu=64, O=16, H=1, Cl=35,5, N=14, Na=23)
A. 60
B. 84
C. 13
D. 30
Đáp án : D
Gọi số mol Mg = Fe = x ; số mol Al = y ; số mol Cu = z trong X
=> 80x + 27y + 64z = 7,5g
2 n H 2 = 2nMg + 2nFe + 3nAl
=> 4x + 3y = 0,46 mol
Khi cho 1 lượng vừa đủ Mg(NO3)2 để phản ứng với Cu và Fe2+
tạo khí không màu hóa nâu trong không khí (NO)
=> NO3- chuyển hoàn toàn thành NO
=> bảo toàn e : 2nCu + n F e 2 + = 3nNO = 3 n N O 3
=> n N O 3 = (2z + x)/3 mol
=> n M g N O 3 2 = (x + 2z)/6 (mol)
=> Khi phản ứng với NaOH tạo kết tủa gồm :
x mol Fe(OH)3 ; [x + (x + 2z)/6 ] mol Mg(OH)2 và z mol Cu(OH)2
=> 9,92g = 524x/3 + 352z/3
=> x = 0,04 ; y = 0,1 ; z = 0,025 mol
=>%mFe(X) = 29,87%
Đúng 0
Bình luận (0)
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hết chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt (không còn khí dư). Hòa tan hết hốn hợp này trong một lượng dung dịch HCl (lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là A. 5,60. B. 6,44. C....
Đọc tiếp
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hết chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt (không còn khí dư). Hòa tan hết hốn hợp này trong một lượng dung dịch HCl (lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là
A. 5,60.
B. 6,44.
C. 5,88.
D. 6,72.
Đáp án D
Ta có: n H C l p h ả n ứ n g = 2 n O = 0 , 12 . 2 = 0 , 24 m o l → n H C l d ư = 0 , 06 m o l
Cho AgNO3 dư vào X thu được kết tủa gồm AgCl và Ag.
Bảo toàn Cl:
n A g C l = 0 , 03 . 2 + 0 , 24 + 0 , 06 = 0 , 36 m o l → n A g = 0 , 015 m o l
Cho AgNO3 vào X thì xảy ra quá trình:
4 H + + N O 3 - + 3 e → N O + 2 H 2 O A g + + e → A g
Bảo toàn e toàn quá trình:
n F e = 0 , 06 . 4 + 0 , 03 . 2 + 0 , 06 . 3 4 + 0 , 015 3 = 0 , 12 m o l → m = 6 , 72 g a m
Đúng 0
Bình luận (0)
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hết chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt (không còn khí dư). Hòa tan hết hốn hợp này trong một lượng dung dịch HCl (lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là A. 5,60. B. 6,44. C. 5,88....
Đọc tiếp
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hết chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt (không còn khí dư). Hòa tan hết hốn hợp này trong một lượng dung dịch HCl (lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là
A. 5,60.
B. 6,44.
C. 5,88.
D. 6,72.
Đáp án D
Ta có
![]()
![]()
Cho AgNO3 dư vào X thu được kết tủa gồm AgCl và Ag.
Bảo toàn Cl: ![]()
![]()
Cho AgNO3 vào X thì xảy ra quá trình:
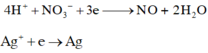
Bảo toàn e toàn quá trình:
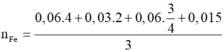
=> m = 6,72 (g)
Đúng 1
Bình luận (0)
D vì:
Ta có
Cho AgNO3 dư vào X thu được kết tủa gồm AgCl và Ag.
Bảo toàn Cl:
Cho AgNO3 vào X thì xảy ra quá trình:
Bảo toàn e toàn quá trình:
=> m = 6,72 (g)
Đúng 0
Bình luận (0)
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hết chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt (không còn khí dư). Hòa tan hết hốn hợp này trong một lượng dung dịch HCl (lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của ml A. 5,88 B. 5,60 C. 6,44 D. 6...
Đọc tiếp
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hết chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt (không còn khí dư). Hòa tan hết hốn hợp này trong một lượng dung dịch HCl (lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của ml
A. 5,88
B. 5,60
C. 6,44
D. 6,72
Nung hỗn hợp X gồm 11,2 gam Fe và 4,8 gam S trong bình kín không có không khí đến phản ứng
hoàn toàn thu được chất rắn Y.
a) Tính khối lượng của từng chất trong Y.
b) Hòa tan hỗn hợp Y trong dung dịch HCl dư thu được hỗn hợp khí Z. Tính thể tích của Z (ở đktc)và tỉ khối của Z so với hiđro.
\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: Fe + S --to--> FeS (1)
LTL: \(0,2>0,15\rightarrow\) Fe dư
Theo pthh (1):
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,15\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\\m_{FeS}=0,15.88=13,2\left(g\right)\end{matrix}\right.\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2S
0,15 0,15
Fe + 2HCl ---> FeCl2 + H2
0,05 0,05
\(\rightarrow M_Z=\dfrac{0,15.34+0,05.2}{0,15+0,05}=26\left(\dfrac{g}{mol}\right)\)
=> dZ/H2 = \(\dfrac{26}{2}=13\)
Đúng 3
Bình luận (1)
Đốt nóng hỗn hợp X gồm bột Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Cho A tác dụng với một lượng dư dung dịch HCl thu được sản phẩm khí Y có tỷ khối hơi so với H2 là 13. Lấy 2,24lit khí Y(đktc) đem đốt cháy rồi cho sản phẩm cháy đó qua 100ml dung dịch H2O2 5,1% (khối lượng riêng d 1gam/ml), sau phản ứng thu được dung dịch B. Cho rằng các phản ứng xảy ra hoàn toàna. Viết các phương trình hóa học xảy rab. Xác định thành phần phần trăm theo khối lượng của mỗi chất trong h...
Đọc tiếp
Đốt nóng hỗn hợp X gồm bột Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Cho A tác dụng với một lượng dư dung dịch HCl thu được sản phẩm khí Y có tỷ khối hơi so với H2 là 13. Lấy 2,24lit khí Y(đktc) đem đốt cháy rồi cho sản phẩm cháy đó qua 100ml dung dịch H2O2 5,1% (khối lượng riêng d = 1gam/ml), sau phản ứng thu được dung dịch B. Cho rằng các phản ứng xảy ra hoàn toàn
a. Viết các phương trình hóa học xảy ra
b. Xác định thành phần phần trăm theo khối lượng của mỗi chất trong hỗn hợp X
c. Xác định nồng độ phần trăm các chất trong hỗn hợp B
Cho 7,36 gam hỗn hợp X gồm Mg và Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng dư thu được 5,04 lít khí SO2 đktc (là sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Z được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 7,2 gam hỗn hợp rắn. Phần trăm khối lượng của Fe trong X là: A. 38,04% B. 83,7% C. 60,87% D. 49,46%
Đọc tiếp
Cho 7,36 gam hỗn hợp X gồm Mg và Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Hòa tan hết Y bằng dung dịch H2SO4 đặc nóng dư thu được 5,04 lít khí SO2 đktc (là sản phẩm khử duy nhất). Cho dung dịch NaOH dư vào Z được kết tủa T. Nung T trong không khí đến khối lượng không đổi được 7,2 gam hỗn hợp rắn. Phần trăm khối lượng của Fe trong X là:
A. 38,04%
B. 83,7%
C. 60,87%
D. 49,46%
Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%
Đúng 0
Bình luận (0)
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt. Hòa tan hết hỗn hợp này trong một lượng dung dịch HCl ( lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là A. 6,72. B. 5,60. C. 5,96...
Đọc tiếp
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt. Hòa tan hết hỗn hợp này trong một lượng dung dịch HCl ( lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là
A. 6,72.
B. 5,60.
C. 5,96.
D. 6,44.
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt. Hòa tan hết hỗn hợp này trong một lượng dung dịch HCl ( lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là? A. 6,72 B. 5,60 C. 5,96. D. 6,44.
Đọc tiếp
Cho m gam bột Fe vào bình kín chứa đồng thời 0,06 mol O2 và 0,03 mol Cl2, rồi đốt nóng. Sau khi các phản ứng xảy ra hoàn toàn chỉ thu được hỗn hợp chất rắn chứa các oxit sắt và muối sắt. Hòa tan hết hỗn hợp này trong một lượng dung dịch HCl ( lấy dư 25% so với lượng cần phản ứng) thu được dung dịch X. Cho dung dịch AgNO3 dư vào X, sau khi kết thúc các phản ứng thì thu được 53,28 gam kết tủa (biết sản phẩm khử của N+5 là khí NO duy nhất). Giá trị của m là?
A. 6,72
B. 5,60
C. 5,96.
D. 6,44.
nHCl cần = 2nO trong oxit = 0,24 mol → nHCl đã dùng (dư 25%) = 0,3 mol.
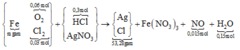
Ghép cụm có nH2O = nO trong oxit + 2nNO
→ nNO = 0,015 mol.
∑nCl = 0,36 mol đi hết vào 53,28 gam tủa
→ về nguyên tố nAg trong tủa = 0,375 mol
Bảo toàn N có nFe(NO3)3 = (0,375 – 0,015) ÷ 3 = 0,12 mol.
→ Yêu cầu m = mFe = 0,12 × 56 = 6,72 gam.
Đáp án A
Đúng 0
Bình luận (0)












