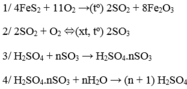III. AXIT SUNFURIC( H2SO4)
4. Sản xuất axit sunfuric
Câu hỏi :
1. Hãy cho biết quá trình sản xuất axit sunfuric từ lưu huỳnh gồm mấy công đoạn ? Đó là công đoạn nào?
2. Viết các PTHH của các phản ứng xảy ra đối với mỗi công đoạn đó

Những câu hỏi liên quan
Hãy cho biết quá trình sản xuất axit sunfuric từ lưu huỳnh gồm mấy công đoạn
Viết PTHH của các phản ứng xảy ra đối với mỗi công đoạn đó
Gồm 3 công đoạn
\(\left(1\right)S+O_2-^{t^o}\rightarrow SO_2\\ \left(2\right)2SO_2+O_2-^{t^o,V_2O_5}\rightarrow2SO_3\\ \left(3\right)SO_3+H_2O\rightarrow H_2SO_4\)
Đúng 3
Bình luận (0)
Quá trình sản xuất axit sunfuric từ lưu huỳnh gồm 3 công đoạn:
Sản xuất SO2 bằng cách đốt S trong không khí: S+O2→SO2Sản xuất SO3 từ SO2: 2SO2+O2→2SO3Sản xuất H2SO4 từ SO3: SO3+H2O→H2SO4
Đúng 1
Bình luận (1)
Trong công nghiệp sunfuric axit được sản xuất bằng phương pháp tiếp xúc theo sơ đồ phản ứng a viết phương trình hóa học của các phản ứng xảy ra trong quy trình trên b giai đoạn 2 là giai đoạn quan trọng nhất của chu trình sản xuất sunfuric axit giả sử trong bình phản ứng dung tích 1 lít ban đầu có 0,4 mol SO2 và 0,6 mol o2 được giữ ở nhiệt độ không đổi khi đạt đến trạng thái cân bằng lượng SO3 trong bình là 0,3 mol tính hằng số cân bằng của phản ứng
Đọc tiếp
Trong công nghiệp sunfuric axit được sản xuất bằng phương pháp tiếp xúc theo sơ đồ phản ứng a viết phương trình hóa học của các phản ứng xảy ra trong quy trình trên b giai đoạn 2 là giai đoạn quan trọng nhất của chu trình sản xuất sunfuric axit giả sử trong bình phản ứng dung tích 1 lít ban đầu có 0,4 mol SO2 và 0,6 mol o2 được giữ ở nhiệt độ không đổi khi đạt đến trạng thái cân bằng lượng SO3 trong bình là 0,3 mol tính hằng số cân bằng của phản ứng
Năm 1995, ở Quận Tân bình, Thành phố Hồ Chí Minh có một nhà máy sản xuất
axit sunfuric H2SO4. Quy trình sản sản xuất axit sunfuric gồm 3 giai đoạn chính như
sau: Giai đoạn 1, oxi hóa lưu huỳnh bởi khí oxi tạo thành lưu huỳnh đioxit (A). Giai
đoạn 2, oxi hóa lưu huỳnh đioxit bởi khí oxi tạo thành lưu huỳnh trioxit (B). Giai đoạn
3, cho lưu huỳnh trioxit tác dụng với nước tạo thành axit sunfuric.
a. Viết công thức hóa học của (A), (B) và phân loại các oxit đó.
b. Viết 3 phương trình hóa học của ph...
Đọc tiếp
Năm 1995, ở Quận Tân bình, Thành phố Hồ Chí Minh có một nhà máy sản xuất
axit sunfuric H2SO4. Quy trình sản sản xuất axit sunfuric gồm 3 giai đoạn chính như
sau: Giai đoạn 1, oxi hóa lưu huỳnh bởi khí oxi tạo thành lưu huỳnh đioxit (A). Giai
đoạn 2, oxi hóa lưu huỳnh đioxit bởi khí oxi tạo thành lưu huỳnh trioxit (B). Giai đoạn
3, cho lưu huỳnh trioxit tác dụng với nước tạo thành axit sunfuric.
a. Viết công thức hóa học của (A), (B) và phân loại các oxit đó.
b. Viết 3 phương trình hóa học của phản ứng thể hiện quá trình sản xuất axit
sunfuric H2SO4 trên.
a) A là SO2: lưu huỳnh đi oxit => oxit axit
B là SO3 : lưu huỳnh tri oxit => oxit axit
b) \(S+O2-->SO2\)
\(2SO2+O2-->2SO3\)
\(SO3+H2O-->H2SO4\)
Từ 80 tấn quặng pirit chứa 40% lưu huỳnh, người ta sản xuất được 73,5 tấn axit sunfuric. Tính hiệu suất của quá trình sản xuất axit sunfuric.
Khối lượng lưu huỳnh chứa trong 80 tấn quặng:
m S = 80x40/100 = 32 tấn
Điều chế H 2 SO 4 theo sơ đồ sau
S → SO 2 → SO 3 → H 2 SO 4
Ta thấy: Cứ 32g S thì sản xuất được 98g H 2 SO 4
⇒ m H 2 SO 4 = 32x98/32 = 98 tấn
Hiệu ứng phản ứng: H = 73,5/98 x 100 = 75%
Đúng 0
Bình luận (0)
Từ 40 tấn quặng Pirit chứa 40% lưu huỳnh, người ta sản xuất được 73,5 tấn axit sunfuric.
a) Tính hiệu suất của quá trình sản xuất axit sunfuric.
b) Tính khối lượng của dd axit sunfuric 50% thu được từ 73,5 tấn H2SO4 đã được sản xuất ở trên 

Đề có phải là : ' Từ 80 tấn quặng Pirit chứa 40% lưu huỳnh , người ta sản xuất được 73,5 tấn axit sunfuric . '' đúng không
không phải
Câu 7: Từ 160 tấn quạng pipi sắt FeS2 (chứa 40% lưu huỳnh Agta sản xuất được 147 tấn axit sunfuric. Tính hiệu suất của quá trình sản xuất axit sunfuric H2SO4
: trog FeS2 có : %S = (32*2*100):120 = 160/3%* 40% = 64g
mFé2 = 64*160/3% = 120 TẤN
120 TẤN TẠO 196 (98*2) TẤN AXIT
H = 147*100/196=75%
Đúng 0
Bình luận (0)
Trong công nghiệp người ta sản xuất axit sunfuric theo sơ đồ sau: FeS2 → SO2 → SO3 → H2SO4. Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axit sunfuric từ quặng trên là: A. 40%. B. 60%. C. 80%. D. 62,5%
Đọc tiếp
Trong công nghiệp người ta sản xuất axit sunfuric theo sơ đồ sau:
FeS2 → SO2 → SO3 → H2SO4.
Người ta sử dụng 15 tấn quặng pirit sắt (chứa 80% FeS2) để sản xuất ra 39,2 tấn dung dịch H2SO4 40%. Vậy hiệu suất chung cho cả quá trình sản xuất axit sunfuric từ quặng trên là:
A. 40%.
B. 60%.
C. 80%.
D. 62,5%
Đáp án C.
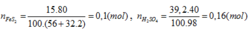
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%
Đúng 0
Bình luận (0)
Câu 1.Quá trình sản xuất axit sunfuric gồm những giai đoạn nào?viết phương trình hóa học của mỗi giai đoạn (ghi rõ điều kiện phản ứng nếu có)
Câu 2. Hòa tan hoàn toàn 1,10 g hỗn hợp gồm hai kim loại an và Fe vào bình đựng dung dịch HCl dư thu được 0,896 lít khí H₂(đktc)
a. Tính thành phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu
b. Nếu cho hỗn hợp kim loại trên tác dụng với a gam dung dịch NaOH 16% (vừa đủ). Tính giá trị a
Đọc tiếp
Câu 1.Quá trình sản xuất axit sunfuric gồm những giai đoạn nào?viết phương trình hóa học của mỗi giai đoạn (ghi rõ điều kiện phản ứng nếu có) Câu 2. Hòa tan hoàn toàn 1,10 g hỗn hợp gồm hai kim loại an và Fe vào bình đựng dung dịch HCl dư thu được 0,896 lít khí H₂(đktc) a. Tính thành phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu b. Nếu cho hỗn hợp kim loại trên tác dụng với a gam dung dịch NaOH 16% (vừa đủ). Tính giá trị a
II-Tự luậnAxit sunfuric là hóa chất hàng đầu được dùng trong nhiều ngành công nghiệp. Hàng năm, các nước trên thế giới sản xuất ra khoảng 160 triệu tấn. Viết PTHH sản xuất
H
2
S
O
4
từ
F
e
S
2
theo sơ đồ:
F
e
S
2
→
S
O
2
→
S
O
3...
Đọc tiếp
II-Tự luận
Axit sunfuric là hóa chất hàng đầu được dùng trong nhiều ngành công nghiệp. Hàng năm, các nước trên thế giới sản xuất ra khoảng 160 triệu tấn. Viết PTHH sản xuất H 2 S O 4 từ F e S 2 theo sơ đồ: F e S 2 → S O 2 → S O 3 → o l e u m → H 2 S O 4 .