Một bình kín dung tích không đổi chứ 10 lít hh N2 và H2 theo tỉ lệ 2:3 về thể tích. Thực hiện tổng hợp NH3 sau phản ứng đưa về đk ban đầu thấy áp suất trong bình giảm 15%. Thể tích NH3 thu được là:
A 1,5 lít B 1,0 lít C 2,25 lít D 1,765 lít
Trong một bình kín dung tích 56 lít (không đổi) chứa N2 và H2 theo tỷ lệ thể tích là 1:4. Ở 00C, áp suất 200 atm (xt Fe3O4). Nung nóng bình một thời gian sau đó đưa bình về nhiệt độ 00C thấy áp suất trong bình giảm 10% so với áp suất ban đầu.
Tính hiệu suất của phản ứng điều chế NH3?
A. 25%
B. 20%
C. 75%
D. 45%
Đáp án A
N2 và H2 theo tỷ lệ thể tích là 1 : 4 tính hiệu suất theo N2
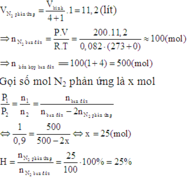
Trong một bình kín dung tích 56 lít (không đổi) chứa N2 và H2 theo tỷ lệ thể tích là 1:4. Ở 00C, áp suất 200 atm (xt Fe3O4). Nung nóng bình một thời gian sau đó đưa bình về nhiệt độ 00C thấy áp suất trong bình giảm 10% so với áp suất ban đầu.
Lấy toàn bộ lượng NH3 trên thì có thể điều chế được bao nhiêu lít dd NH3 nồng độ 25% (d = 0,907 g/ml)
A. 0,1376 lít
B. 2,838 lít
C. 3,784 lít
D. 3,4056 lít
Trong bình kín thể tích không đổi 56lít chứa N2, H2 theo tỉ lệ thể tích 1 : 4 ở nhiệt độ 00C, áp suất 200atm và ít xúc tác (thể tích xúc tác không đáng kể). Nung nóng bình một thời gian sau đưa về 00C thấy áp suất giảm 5% so với ban đầu. Tính hiệu suất phản ứng tổng hợp amoniac là
A. 20%
B. 12,5%
C. 15%
D. 10%
Chọn B. nhh= 500 mol → nN2= 100 mol ; nH2= 400 mol.
N2 + 3H2 → 2NH3
| Mol đầu |
100 |
400 |
0 |
| Mol pứ |
x |
3x |
0 |
| Mol cb |
100-x |
400-3x |
2x |
n hh sau = (400-2x) mol
Đề cho
n1.P2=n2.P1 bới P2=0,95P1
0,95.400= 400-2x
x= 12,5 mol.
Tính hiệu suất theo N2 → H%= 12,5 % (Tính hiệu suất theo chất nào mà kết quả ra cao hơn)
Một bình kín dung tích không đổi chứa hỗn hợp cùng thể tích khí N2 và H2 ở 0oC, 100atm. Sau khi tiến hành tổng hợp NH3, đưa nhiệt độ bình về 0oC, áp suất mới của bình là 90atm. Hiệu suất phản ứng tổng hợp NH3 là:
A. 10%
B. 25%
C. 20%
D. 30%
Đáp án D
Đặt nH2= nN2= a mol (ban đầu)
→ Tổng số mol khí ban đầu n1= a+a=2a (mol)
Do  nên hiệu suất tính theo H2
nên hiệu suất tính theo H2
Đặt nH2 pứ= x mol
N2 + 3H2 ⇌ 2NH3
Ban đầu a a mol
Phản ứng x/3 x 2x/3 mol
Sau pứ (a-x/3) (a-x) 2x/3 mol
Tổng số mol khí sau phản ứng n2= (a-x/3) + (a-x) + 2x/3= 2a- 2x/3 (mol)
Trong cùng điều kiện về nhiệt độ, tỉ lệ số mol bằng tỉ lệ áp suất

Trong bình kín dung tích không đổi chứa hỗn hợp khí X gồm H2 và N2 (chất xúc tác thích hợp), áp suất trong bình là p atm, tỉ khối của X so với H2 là 5. Nung nóng bình để thực hiện phản ứng tổng hợp NH3, rồi làm nguội bình về nhiệt độ ban đầu, thu được hỗn hợp khí Y, áp suất trong bình là 0,88p atm. Hiệu suất phản ứng tổng hợp NH3 là
A. 26,0%. B. 19,5%. C. 24,0%. D. 20,0%.
Trong một bình kín dung tích 56 lít chứa đầy N2 và H2 theo tỉ lệ thể tích 1:4 ở 00C và 200atm, có một ít bột xúc tác Ni. Nung nóng bình một thời gian, sau đó đưa về 00C thì áp suất trong bình giảm 10% so với áp suất ban đầu. Hiệu suất của phản ứng là:
A. 18,75%
B. 20%
C. 30%
D. 25%
Đáp án D.
Ban đầu: nhỗn hợp= PV/RT= 56.200/0,082.273= 500 mol
→nN2=100 mol, nH2= 400 mol

Sau khi phản ứng xảy ra đưa về 00C thì áp suất trong bình giảm 10% so với áp suất ban đầu
→Số mol khí cũng giảm 10%
→nkhí sau pứ= 500- 10%.500= 450 mol
Mà nkhí sau pứ= (100-x)+ (400-3x)+2x= 450
→x=25 mol
→H= (x/100).100%=25%
Cho 5 lít N2 và 15 lít H2 vào một bình kín dung tích không đổi . Ở 00C, áp suất trong bình là P1 atm. Đun nóng bình một thời gian thấy có 20% N2 tham gia phản ứng, đưa bình về nhiệt độ ban đầu thấy áp suất trong bình lúc này là P2 atm. Tỉ lệ P1 và P2 là:
A. 6 : 10
B. 10 : 6
C. 10 : 9
D. 9 : 10
Đáp án C.
N2+ 3H2 ⇌ 2NH3
Vì có  nên hiệu suất phản ứng tính theo N2 hoặc H2
nên hiệu suất phản ứng tính theo N2 hoặc H2
Giả sử ban đầu có 1 mol N2 và 3 mol H2, nkhí ban đầu= 4 mol
→nN2 pứ= 1.20%= 0,2 mol
N2+ 3H2 ⇌ 2NH3
Ban đầu 1 3 mol
Phản ứng 0,2 0,6 0,4 mol
Sau pứ 0,8 2,4 0,4 mol
nkhí sau pứ= 0,8 + 2,4 + 0,4= 3,6 mol
Trong cùng điều kiện nhiệt độ và thể tích thì tỉ lệ về số mol chính là tỉ lệ về áp suất

Trộn 10 lít N2 với 40 lít H2 rồi nung nóng một thời gian, sau đó đưa về to và áp suất ban đầu thấy thu được 42 lít hỗn hợp A gồm N2, H2 và NH3.
a/ Tính thể tích H2 đã phản ứng.
b/ Tính hiệu suất phản ứng.
c/ Tính thể tích mỗi khí trong hỗn hợp A.
N2 + 3H2 → 2NH3
Cứ 1 lít N2 phản ứng với 3 lít H2 tạo thành 2 lít NH3 thì thể tích giảm:
3 + 1 - 2 = 2 (lít)
Ở đây, tổng thể tích khí trước và sau phản ứng (đo cùng điều kiện) là 50 lít và 48 lít, tức giảm 2 lít.
Vậy V(NH3) = 2 lít
Nếu phản ứng hoàn toàn (100%) thì N2 phản ứng hết và H2 dư. Hiệu suất được tính theo N2:
H = (1/10).100% = 10%
*TK