Dung dịch X chứa a mol NH4+ ; b mol Al3+; c mol Mg2+; x mol NO3– ; y mol SO42– . Mối quan hệ giữa số mol các ion trong dung dịch là
A. a + b +c = x + y
B. a + 3b + 2c = x + 2y
C. a + b/3 + c/2 = x + y/2
a + 2b +3c = x + 2y
Một dung dịch X có chứa a mol NH4+, b mol Ba2+ và c mol Cl-. Nhỏ dung dịch Na2SO4 đến dư vào dung dịch X thu được 34,95 gam kết tủa. Mối quan hệ giữa a và c là:
A. c - a = 0,3
B. a = c
C. a - c = 0,3
D. a + c = 0,3
Đáp án A
Ba2++ SO42- → BaSO4
nSO4(2-) = nBaSO4 = 34,95/233=0,15 mol = nBa2+
Theo ĐLBT ĐT thì a+2b = c suy ra a+2.0,15 = c nên c-a = 0,3
dd X chứa a mol NH4+, b mol Al3+, c mol Mg2+, x mol NO3-, y mol SO42-. Mối quan hệ số mol các ion trong dung dịch là
A. a+ b +c =x +y
B. a + 3b+2c = x +2y
C. a +b/3 + c/2 = x +y/2
D. a +2b +3c = x + 2y
Đáp án B
Bảo toàn điện tích a + 3b +2c = x +2y
Một dung dịch có chứa 0,02 mol NH4+, x mol Fe3+, 0,01 mol Cl- và 0,02 mol SO42-. Khi cô cạn dung dịch này thu được lượng muối khan là:
A. 2,635 gam
B. 3,195 gam
C. 4,315 gam
D. 4,875 gam
Đáp án B
Theo định luật bảo toàn điện tích: 0,02.1+ 3.x= 0,01.1+ 0,02.2
Suy ra x=0,01 mol
Khối lượng muối khan thu được khi cô cạn dung dịch là:
0,02.18+ 0,01.56+ 0,01.35,5+ 0,02.96= 3,195 gam
Một dung dịch Y có chứa các ion: Mg2+ (0,05 mol), K+ (0,15 mol), NO3- (0,1 mol), và SO42- (x mol). Khối lượng chất tan có trong dung dịch Y là
Cho 200 ml dung dịch X chứa các ion NH4+ (0,5M), K+ (0,1M), SO42- (0,25M), Cl- (aM). Biết rằng dung dịch X được điều chế bằng cách hoà tan 2 muối vào nước. Khối lượng của 2 muối được lấy là
giải dùm mình cần gấp tối nay lúc 10h giúp dùm mình cần gấp
Dung dịch X chứa 0.01 mol Fe3+, 0.02 mol NH4+, 0.02 mol SO4 2-
và x mol
3NO−.
a. Tính x.
b. Trộn dung dịnh X với 100 ml dung dịch Ba(OH)2 0.3 M thu được m gam kết tủa và V lít khí (đktc). Tính m và V.
a.
Bảo toàn điện tích :
\(n_{NO_3^-}=0.01\cdot3+0.02-0.02\cdot2=0.01\left(mol\right)\)
b.
\(n_{Ba\left(OH\right)_2}=0.1\cdot0.3=0.03\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.02.....0.02..........0.02\)
\(Ba^{2+}dư\)
\(m_{BaSO_4}=0.02\cdot233=4.66\left(g\right)\)
\(NH_4^++OH^-\rightarrow NH_3+H_2O\)
\(0.02.......0.02........0.02\)
\(V_{NH_3}=0.02\cdot22.4=0.448\left(l\right)\)
\(OH^-dư\)
Một dung dịch có chứa các ion: NH 4 + (0,1 mol), K + (0,15 mol), NO 3 - (0,1 mol), và CO 3 2 - (x mol). Cho dung dịch X tác dụng với lượng dư dung dịch BaCl 2 thu được m gam kết tủa. Giá trị của m là
A. 9,85.
B. 14,775.
C. 19,7.
D. 16,745.
Chọn B
Bảo toàn điện tích có: 0,1 + 0,15 = 0,1 + 2x → x = 0,075 mol
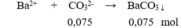
m↓ = 0,075.197 = 14,775 gam.
Cho m gam hỗn hợp X gồm sắt và các oxit sắt vào dung dịch HCl loãng dư thu được a mol H 2 và dung dịch có chứa 41,91 gam FeCl2. Mặt khác, hòa tan hết m gam X trên trong dung dịch chứa 1,6 mol HNO3 thu được dung dịch Y (không chứa ion NH 4 + ) và hỗn hợp khí Z gồm 0,15 mol NO và 0,08 mol NO2. Cho từ từ 440 ml dung dịch NaOH 1M vào Y thu được 10,7 gam một kết tủa duy nhất. Giá trị của a là:
A. 0,10
B. 0,08
C. 0,12
D. 0,14
Cho m gam hỗn hợp X gồm Fe và các oxit vào dung dịch HCl loãng dư thu được a mol H2 và dung dịch có chứa 45,46 gam hỗn hợp muối. Mặt khác, hòa tan hết m gam X trên trong dung dịch chứa 1,2 mol HNO3 thu được dung dịch Y (không chứa ion NH4+ ) và hỗn hợp khí Z gồm 0,08 mol NO và 0,07 mol NO2. Cho từ từ 360 ml dung dịch NaOH 1M vào Y thu được 10,7 gam một kết tủa suy nhất. Giá trị của a là:
A. 0,05
B. 0,04
C. 0,06
D. 0,07
Cho m gam hỗn hợp X gồm Fe và các oxit vào dung dịch HCl loãng dư thu được a mol H2 và dung dịch có chứa 45,46 gam hỗn hợp muối. Mặt khác, hòa tan hết m gam X trên trong dung dịch chứa 1,2 mol HNO3 thu được dung dịch Y (không chứa ion NH4+ ) và hỗn hợp khí Z gồm 0,08 mol NO và 0,07 mol NO2. Cho từ từ 360 ml dung dịch NaOH 1M vào Y thu được 10,7 gam một kết tủa suy nhất. Giá trị của a là:
A. 0,05
B. 0,04
C. 0,06
D. 0,07
Đáp án B
Định hướng tư duy giải
Ta có:
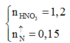
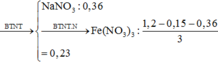
Và
