Nêu vị trí trong bảng tuần hoàn của các nguyên tố có Z = 8; Z = 11; Z = 17 và Z = 20. Xác định số electron hóa trị của nguyên tử các nguyên tố đó.

Những câu hỏi liên quan
trong bảng hệ thống tuần hoàn các nguyên tố, nguyên tố A có số thứ tự Z=8, nguyên tố B có số tứ tự Z=15 viết cấu hình e của A và B với đầy đủ các ô lượng tử xác định vị trí của A và B trong bảng tuần hoàn cho biết tên của A và B
Vị trí của nguyên tố Al (Z13) trong bảng tuần hoàn các nguyên tố hóa học là: A. Ô 13, nhóm IA, chu kì 3. B. Ô 13, nhóm IB, chu kì 3. C. Ô 13, nhóm IIIA, chu kì 3. D. Ô 13, nhóm IIIB, chu kì 3.
Đọc tiếp
Vị trí của nguyên tố Al (Z=13) trong bảng tuần hoàn các nguyên tố hóa học là:
A. Ô 13, nhóm IA, chu kì 3.
B. Ô 13, nhóm IB, chu kì 3.
C. Ô 13, nhóm IIIA, chu kì 3.
D. Ô 13, nhóm IIIB, chu kì 3.
Đáp án C
- Viết cấu hình electron của Al: 1s22s22p63s23p1
=> Al ở ô thứ 13 (có 13 proton) ; nhóm IIIA (có 3 e lớp ngoài cùng 3s23p1 và e cuối điền vào phân lớp p) ; chu kỳ 3 (e cuối cùng điền vào lớp thứ 3)
Đúng 0
Bình luận (0)
Tìm vị trí các nguyên tố (ô, chu kì, nhóm) trong bảng tuần hoàn có Z= 7; 11; 13; 16; 19 mà không được dùng bảng tuần hoàn.
a)\(Z=7\Rightarrow1s^22s^22p^3\)
Nguyên tố nằm ở ô thứ 7, chu kì 2 nhóm VA.
b)\(Z=11\Rightarrow1s^22s^22p^63s^1\)
Nguyên tố nằm ở ô thứ 11,chu kì 1 nhóm lA.
c)\(Z=13\Rightarrow1s^22s^22p^63s^23p^1\)
Nguyên tố nằm ở ô thứ 13, chu kì 3 nhóm lllA.
d)\(Z=16\Rightarrow1s^22s^22p^63s^23p^4\)
Nguyên tố nằm ở ô thứ 16, chu kì 3 nhóm VIA.
e)\(Z=19\Rightarrow1s^22s^22p^63s^23p^64s^1\)
Nguyên tố nằm ở ô thứ 19, chu kì 4 nhóm IA.
Đúng 2
Bình luận (0)
Nguyên tố oxi có số hiệu nguyên tử là 8. Vị trí của oxi trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kì 3, nhóm VIA
B. chu kì 2, nhóm VIA
C. chu kì 3, nhóm IVA
D. chu kì 2, nhóm IVA
Vị trí của P (z = 15) trong bảng tuần hoàn các nguyên tố hóa học là
A. ô 15, chu kỳ 2, nhóm VA.
B. ô 15, chu kỳ 3, nhóm VA.
C. ô 15, chu kỳ 2, nhóm IIIA.
D. ô 15, chu kỳ 3, nhóm IIIA.
Chọn B
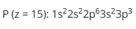
P thuộc ô 15 (do z = 15), chu kỳ 3 (do có 3 lớp electron), nhóm VA (do 5 electron lớp ngoài cùng, nguyên tố p).
Đúng 0
Bình luận (0)
Các nguyên tố X, Y, Z, T có số hiệu nguyên tử tương ứng là 4, 8, 16, 25. Kết luận nào dưới đây về vị trí nguyên tố trong bảng tuần hoàn là đúng? A. Số hiệu nguyên tử là 4; chu kỳ 2; nhóm IV B. Số hiệu nguyên tử là 8; chu kỳ 2; nhóm IV C. Số hiệu nguyên tử là 16; chu kỳ 3; nhóm VI D. Số hiệu nguyên tử là 25; chu kỳ 4; nhóm V
Đọc tiếp
Các nguyên tố X, Y, Z, T có số hiệu nguyên tử tương ứng là 4, 8, 16, 25. Kết luận nào dưới đây về vị trí nguyên tố trong bảng tuần hoàn là đúng?
A. Số hiệu nguyên tử là 4; chu kỳ 2; nhóm IV
B. Số hiệu nguyên tử là 8; chu kỳ 2; nhóm IV
C. Số hiệu nguyên tử là 16; chu kỳ 3; nhóm VI
D. Số hiệu nguyên tử là 25; chu kỳ 4; nhóm V
C
X ( Z = 4): 1 s 2 2 s 2 → X thuộc chu kỳ 2 (do có 2 lớp electron); nhóm IIA (do có 2 electron hóa trị, nguyên tố s) → A sai.
Y ( Z = 8): 1 s 2 2 s 2 2 p 4 → Y thuộc chu kỳ 2 (do có 2 lớp electron); nhóm VIA (do có 6 electron hóa trị, nguyên tố p) → B sai.
Z (Z = 16): [ N e ] 3 s 2 3 p 4 → Z thuộc chu kỳ 3 (do có 3 lớp electron); nhóm VIA (do có 6 electron hóa trị, nguyên tố p) → C đúng.
T (Z = 25): [ A r ] 3 d 5 4 s 2 → T thuộc chu kỳ 4 (do có 4 lớp electron); nhóm VIIB (do có 7 electron hóa trị, nguyên tố d) → D sai.
Đúng 0
Bình luận (0)
Vị trí của nguyên tử lưu huỳnh (Z = 16) trong bảng tuần hoàn các nguyên tố hoá học là
A. chu kì 2, nhóm VIA
B. chu kì 4, nhóm VIA
C. chu kì 3, nhóm VIA
D. chu kì 3, nhóm IVA
Đáp án C
S (Z = 16): 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 => S thuộc: chu kì 3, nhóm VIA
Đúng 0
Bình luận (0)
Nêu đặc điểm,cách xếp vị trí các nguyên tố trong bảng tuần hoàn
- Nguyên tắc 1: Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Nguyên tắc 2: Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
- Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị trong nguyên tử được sắp xếp thành một cột.
Đúng 0
Bình luận (0)
Nguyên tố R có Z = 35, vị trí của R trong bảng tuần hoàn là
A.Chu kì 4, nhóm VIIA.
B. Chu kì 4, nhóm VB.
C. Chu kì 4, nhóm VA.
D. Chu kì 4, ,nhóm VIIB.
Chọn A
Cấu hình electtron của R là
![]()
R có 4 lớp electron vậy R ở chu kỳ 4.
R có 7 electron lớp ngoài cùng, nguyên tố p, vậy R thuộc nhóm VIIA.
Đúng 0
Bình luận (0)
Dựa vào vị trí của các nguyên tố trong bảng tuần hoàn, hãy nêu rõ trong các nguyên tố sau đây những nguyên tố nào có cùng cộng hóa trị trong các oxit cao nhất:
Si, P, Cl, S, C, N, Se, Br.
Những nguyên tố có cùng cộng hóa trị trong các oxit cao nhất:
RO2 : Si, C
R2O5: P, N
RO3: S, Se
R2O7: Cl, Br
Đúng 0
Bình luận (0)













