nguyên tố X có 3 đồng vị a1, a2 ,a3 , vs tỉ lệ % số nguyên tử lần lượt 92,28 ; 4,67 ; 3,05 có nguyên tử khối tb là 28,1 , số n của a3 hơn số n a1 là 2, a1 + a2 +a3 = 87 , a1 có p=n . Tính a1 , a2 ,a3

Những câu hỏi liên quan
Tính khối lượng nguyên tử của các nguyên tố sau:- Sắt có 4 đồng vị : 55Fe ( 5, 84%) ; 56Fe (91,68%) ; 57Fe ( 2,17%) ; 58Fe- Nguyên tử Ar có các đồng vị: 36Ar ; 38Ar ( 0,06%) ; 40Ar ( 99,69%)- Nguyên tố K trong tự nhiên có các đồng vị: 39K ; 40K ; 41K ; với tỉ lệ tương ứng lần lượt là : 93,08% , 6,12%mong mn giúp đỡ
Đọc tiếp
Tính khối lượng nguyên tử của các nguyên tố sau:
- Sắt có 4 đồng vị : 55Fe ( 5, 84%) ; 56Fe (91,68%) ; 57Fe ( 2,17%) ; 58Fe
- Nguyên tử Ar có các đồng vị: 36Ar ; 38Ar ( 0,06%) ; 40Ar ( 99,69%)
- Nguyên tố K trong tự nhiên có các đồng vị: 39K ; 40K ; 41K ; với tỉ lệ tương ứng lần lượt là : 93,08% , 6,12%
mong mn giúp đỡ
Một nguyên tố X có 2 đồng vị với tỉ lệ số nguyên tử là 27/23.Hạt nhân nguyên tử X có 35 proton. Trong nguyên tử của đồng vị thứ nhất có 44 neutron. Số neutron trong nguyên tử của đồng vị thứ hai nhiều hơn trong đồng vị thứ nhất là 2 neutron. Tính nguyên tử khối trung bình của nguyên tố X.
Tổng 3 phân số tối giản là \(1\frac{17}{20}\). Tử số của phân số 1, phân số 2, phân số 3 lần lượt tỉ lệ với 3, 7, 11 và mẫu của chúng lần lượt tỉ lệ với 10, 20, 40. Tìm 3 phân số đó.
các phân số đó lần lượt là 3/5; 7/10;11/20
Đúng 0
Bình luận (0)
Lần lượt tác dụng có độ lớn
F
1
và
F
2
lên một vật khối lượng m, vật thu được gia tốc có độ lớn lần lượt là
a
1
và
a
2
. Biết 3
F
1
2
F
2
. Bỏ qua mọi ma sát. Tỉ số
a...
Đọc tiếp
Lần lượt tác dụng có độ lớn F 1 và F 2 lên một vật khối lượng m, vật thu được gia tốc có độ lớn lần lượt là a 1 và a 2 . Biết 3 F 1 = 2 F 2 . Bỏ qua mọi ma sát. Tỉ số a 2 / a 1 là
A. 3/2
B. 2/3
C. 3
D. 1/3
Chọn A.
Áp dụng định luật II Niu-tơn ta được:
F 1 = m. a 2 ; F 2 = m. a 2
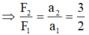
Đúng 0
Bình luận (0)
Bài 4. Nguyên tử của một số nguyên tố có số hiệu nguyên tử là : 11,15,16,19,20. Nêu vị trí và cấu tạo của các nguyên tố này.
11: Na - Ô số 11 chu kì 3 nhóm IA
15: P - Ô số 15 chu kì 3 nhóm VA
16: S - Ô số 16 chu kì 3 nhóm VIA
19: K - Ô số 19 chu kì 4 nhóm IA
20: Ca - Ô số 20 chu kì 4 nhóm IIA
Đúng 1
Bình luận (0)
TK
Na: 11 - Ô số 11 chu kì 3 nhóm I
P :15 - Ô số 15 chu kì 3 nhóm V
S : 16 - Ô số 16 chu kì 3 nhóm VI
K :19- Ô số 19 chu kì 4 nhóm I
Ca :20- Ô số 20 chu kì 4 nhóm II
Đúng 0
Bình luận (0)
Nguyên tử X có 3 đồng vị là X, chiếm 92,23%,X2 chiếm 4,67% và X3 chiếm 3,10%. Tổng số khối của 3 đồng vị bằng 87. Số nơtron trong X2 nhiều hơn trong X1,một hạt. Nguyên tử khối trung bình của X là 28,0855.a)Hãy tìm số khối của 3 đồng vị b)Nếu trong X1 có số nơtron bằng số proton. Hãy tìm số nơtron trong nguyên tử của mỗi đồng vị.
Đọc tiếp
Nguyên tử X có 3 đồng vị là X, chiếm 92,23%,X2 chiếm 4,67% và X3 chiếm 3,10%. Tổng số khối của 3 đồng vị bằng 87. Số nơtron trong X2 nhiều hơn trong X1,một hạt. Nguyên tử khối trung bình của X là 28,0855.
a)Hãy tìm số khối của 3 đồng vị
b)Nếu trong X1 có số nơtron bằng số proton. Hãy tìm số nơtron trong nguyên tử của mỗi đồng vị.
Nguyên tố Oxi có 3 đồng vị: 816O (99,75%); 178O (0,039%); 188O (0,211%). a) Tính nguyên tử khối trung bình của oxi. b) Tính số nguyên tử của các đồng vị còn lại khi có 1 nguyên tử 17O.
Lần lượt tác dụng có độ lớn
F
1
và
F
2
lên một vật khối lượng m, vật thu được gia tốc có độ lớn lần lượt là
a
1
và
a
2
.
F
1
2
F
2
. Bỏ qua mọi ma sát. Tỉ số
a...
Đọc tiếp
Lần lượt tác dụng có độ lớn F 1 và F 2 lên một vật khối lượng m, vật thu được gia tốc có độ lớn lần lượt là a 1 và a 2 . F 1 = 2 F 2 . Bỏ qua mọi ma sát. Tỉ số a 2 a 1 là
A. 3/2.
B. 2/3.
C. 3.
D. 1/3.
Chọn A.
Áp dụng định luật II Niu-tơn ta được:
F1 = m.a1; F2 = m.a2
![]()
Đúng 0
Bình luận (0)
Câu 4 (4 điểm):Biết rằng kim loại kẽm tác dụng với axit clohiđric (HCl) tạo ra muối kẽm clorua (ZnCl2) và khí hiđro (H2). a. Lập PTHH của phản ứng b. Cho biết tỉ lệ số nguyên tử kẽm lần lượt với số phân tử của ba chất khác trong phản ứng.
Đọc tiếp
Câu 4 (4 điểm):
Biết rằng kim loại kẽm tác dụng với axit clohiđric (HCl) tạo ra muối kẽm clorua (ZnCl2) và khí hiđro (H2). a. Lập PTHH của phản ứng
b. Cho biết tỉ lệ số nguyên tử kẽm lần lượt với số phân tử của ba chất khác trong phản ứng.
\(a,Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Tỉ lệ số nguyên tử Kẽm : Số phân tử Axit Clohidric = 1:2
Tỉ lệ số nguyên tử Kẽm : Số phân tử Kẽm Clorua = 1:1
Tỉ lệ số nguyên tử kẽm ; Số phân tử khí Hidro = 1:1
Dạng này khá cơ bản, em coi không hiểu hỏi lại nhé!
Đúng 4
Bình luận (0)













