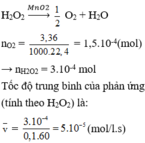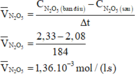Tính tốc độ trung bình của phản ứng (4) theo O2 trong 100 giây đầu tiên.

Những câu hỏi liên quan
Để điều chế một lượng nhỏ clo trong phòng thí nghiệm, người ta tiến hành trộn 100 ml dung dịch HCl 5M với 100 ml dung dịch KclO3 2M. Tốc độ phản ứng trung bình tính theo HCl trong 50 giây đầu tiên là 0,03 (mol/lít.s). Nồng độ HCl trong dung dịch sau 50 giây đầu tiên là A. 0,75M B. 1,00M C. 2,50M D. 1,50M
Đọc tiếp
Để điều chế một lượng nhỏ clo trong phòng thí nghiệm, người ta tiến hành trộn 100 ml dung dịch HCl 5M với 100 ml dung dịch KclO3 2M. Tốc độ phản ứng trung bình tính theo HCl trong 50 giây đầu tiên là 0,03 (mol/lít.s). Nồng độ HCl trong dung dịch sau 50 giây đầu tiên là
A. 0,75M
B. 1,00M
C. 2,50M
D. 1,50M
Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45⁰: N2O5 → N2O4 + ½ O2 Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tốc độ trung bình của phản ứng tính theo N2O5 là A.. 1,36.10-3 mol/(l.s) B. 6,80.10-4 mol/(l.s) C. 6,80.10-3 mol/(l.s) D. 2,72.10-3 mol/(l.s)
Đọc tiếp
Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45⁰:
N2O5 → N2O4 + ½ O2
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M.
Tốc độ trung bình của phản ứng tính theo N2O5 là
A.. 1,36.10-3 mol/(l.s)
B. 6,80.10-4 mol/(l.s)
C. 6,80.10-3 mol/(l.s)
D. 2,72.10-3 mol/(l.s)
Cho chất xúc tác
M
n
O
2
vào 100 ml dung dịch
H
2
O
2
, sau 60 giây thu được 3,36 ml khí
O
2
(đktc). Tốc độ trung bình của phản ứng (tính theo
H
2
O
2
) trong 60 giây trên là A.
2
,
5
.
10...
Đọc tiếp
Cho chất xúc tác M n O 2 vào 100 ml dung dịch H 2 O 2 , sau 60 giây thu được 3,36 ml khí O 2 (đktc). Tốc độ trung bình của phản ứng (tính theo H 2 O 2 ) trong 60 giây trên là
A. 2 , 5 . 10 - 4 m o l / ( l . s )
B. 5 , 0 . 10 - 4 m o l / ( l . s )
C. 1 , 0 . 10 - 3 m o l / ( l . s )
D. 5 , 0 . 10 - 5 m o l / ( l . s )
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là A. 1,0.10-3 mol/(l.s) B. 2,5.10-4 mol/(l.s). C. 5,0.10-4 mol/(l.s). D. 5,0.10-5 mol/(l.s).
Đọc tiếp
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
A. 1,0.10-3 mol/(l.s)
B. 2,5.10-4 mol/(l.s).
C. 5,0.10-4 mol/(l.s).
D. 5,0.10-5 mol/(l.s).
II-Tự luậnCho phản ứng sau :
H
C
O
O
H
+
B
r
2
→
2
H
B
r
+
C
O
2
Lúc đầu nồng độ hơi
B
r
2
0,04 mol/l. Sau 100 giây, nồng độ hơi
B
r
2
còn lại là 0,012 mol/l. Tính tốc độ trung bình của phản ứng theo
B
r...
Đọc tiếp
II-Tự luận
Cho phản ứng sau : H C O O H + B r 2 → 2 H B r + C O 2
Lúc đầu nồng độ hơi B r 2 0,04 mol/l. Sau 100 giây, nồng độ hơi B r 2 còn lại là 0,012 mol/l. Tính tốc độ trung bình của phản ứng theo B r 2 trong khoảng thời gian 100 giây
Cho phản ứng hóa học:
Br
2
+
HCOOH
→
2
HBr
+
CO
2
Lúc đầu nồng độ của HCOOH là 0,010 mol/l, sau 40 giây nồng độ của HCOOH là 0,008 mol/l. Tốc độ trung bình của phản ứng trong khoảng thời gian 40 giây tính theo HCOOH là A. 5,0.10-5 mol/(l.s). B. 2,5.10-5 mol/(l.s). C. 2,5.10-4 mol/(l.s). D. 2,0.10-4 mol/(l.s).
Đọc tiếp
Cho phản ứng hóa học: Br 2 + HCOOH → 2 HBr + CO 2
Lúc đầu nồng độ của HCOOH là 0,010 mol/l, sau 40 giây nồng độ của HCOOH là 0,008 mol/l. Tốc độ trung bình của phản ứng trong khoảng thời gian 40 giây tính theo HCOOH là
A. 5,0.10-5 mol/(l.s).
B. 2,5.10-5 mol/(l.s).
C. 2,5.10-4 mol/(l.s).
D. 2,0.10-4 mol/(l.s).
Cho phản ứng hóa học: Br2 +HCOOH→2HBr+CO2 Lúc đầu nồng độ của HCOOH là 0,010 mol/l, sau 40 giây nồng độ của HCOOH là 0,008 mol/l. Tốc độ trung bình của phản ứng trong khoảng thời gian sau 40 giây tính theo HCOOH là A. 5,0.10-5 mol/(l.s) B. 2,5.10-4 mol/(l.s) C. 2,0.10-4 mol/(l.s) D. 2,5.10-5 mol/(l.s)
Đọc tiếp
Cho phản ứng hóa học: Br2 +HCOOH→2HBr+CO2
Lúc đầu nồng độ của HCOOH là 0,010 mol/l, sau 40 giây nồng độ của HCOOH là 0,008 mol/l. Tốc độ trung bình của phản ứng trong khoảng thời gian sau 40 giây tính theo HCOOH là
A. 5,0.10-5 mol/(l.s)
B. 2,5.10-4 mol/(l.s)
C. 2,0.10-4 mol/(l.s)
D. 2,5.10-5 mol/(l.s)
Chọn đáp án A.
Tốc độ trung bình của phản ứng trong khoảng thời gian 40 giây tính theo HCOOH là:
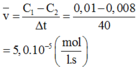
Đúng 0
Bình luận (0)
Thực hiện phản ứng sau trong bình kín:
C
O
(
k
)
+
C
l
2
(
k
)
→
C
O
C
l
2
(
k
)
Lúc đầu nồng độ
C
l
2
là 0,08 mol/l. Sau 1 phút 20 giây, nồng độ
C
l
2
là 0,024 mol/l. Tính tốc độ trung bình của phản ứng tính theo...
Đọc tiếp
Thực hiện phản ứng sau trong bình kín: C O ( k ) + C l 2 ( k ) → C O C l 2 ( k )
Lúc đầu nồng độ C l 2 là 0,08 mol/l. Sau 1 phút 20 giây, nồng độ C l 2 là 0,024 mol/l. Tính tốc độ trung bình của phản ứng tính theo C l 2 trong khoảng thời gian trên.
Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45 độ C
N
2
O
5
→
N
2
O
4
+
1
2
O
2
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tốc độ trung bình của phản ứng tính theo N2O5 là A. 2,72.10-3 mol/(l.s). B. 1,36.10-3 mol/(l.s). C. 6,80.10-3 mol/(l.s). D. 6,80.10-4 mol/(l.s).
Đọc tiếp
Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45 độ C
N 2 O 5 → N 2 O 4 + 1 2 O 2
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tốc độ trung bình của phản ứng tính theo N2O5 là
A. 2,72.10-3 mol/(l.s).
B. 1,36.10-3 mol/(l.s).
C. 6,80.10-3 mol/(l.s).
D. 6,80.10-4 mol/(l.s).