Khi một chất khí bị đốt nóng, các phân tử của nó sẽ thu được năng lượng. Giả sử có thể nhìn thấy các phân tử của khí nóng và khí lạnh (ở cùng áp suất), em sẽ thấy sự khác biệt nào trong chuyển động của chúng?

Những câu hỏi liên quan
Trong một bình kín chứa hỗn hợp gồm hiđrocacbon A và và H2 có xúc tác (thể tích không đáng kể). Nung nóng bình 1 thời gian, thu được 1 khí B duy nhất ở cùng nhiệt độ, áp suất trong bình trước khi nung nóng gấp 3 lần áp suất sau khi nung nóng. Đốt cháy 1 lượng B thu được 8,8g CO2 và 5,4g H2O. Công thức phân tử của A là: A. C2H4 B. C2H2 C. C3H4 D. C4H4
Đọc tiếp
Trong một bình kín chứa hỗn hợp gồm hiđrocacbon A và và H2 có xúc tác (thể tích không đáng kể). Nung nóng bình 1 thời gian, thu được 1 khí B duy nhất ở cùng nhiệt độ, áp suất trong bình trước khi nung nóng gấp 3 lần áp suất sau khi nung nóng. Đốt cháy 1 lượng B thu được 8,8g CO2 và 5,4g H2O. Công thức phân tử của A là:
A. C2H4
B. C2H2
C. C3H4
D. C4H4
Đáp án B
Có ![]()
Gọi công thức hidrocacbon A là ![]() và nA = a.
và nA = a.
Có phản ứng:
![]()
a ka a
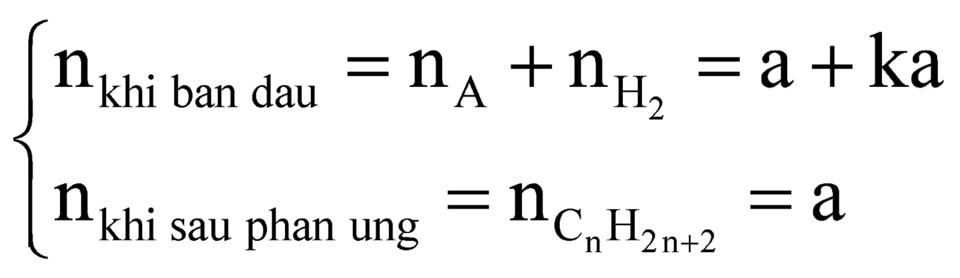
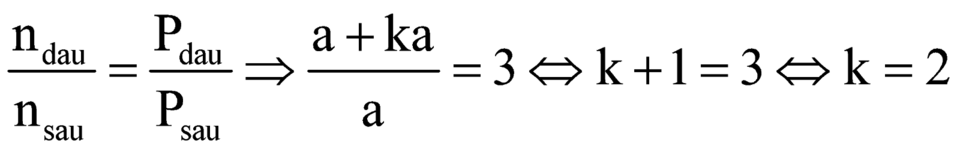
Mặt khác:
![]()
![]() .
.
Vậy A là C2H2.
Đúng 0
Bình luận (0)
Trong bình kín chứa hidrocacbon X và hidro. Nung nóng bình đến khi phản ứng xảy ra hoàn toàn thu được khí Y duy nhất. Ở cùng nhiệt độ, áp suất trong bình trước khi nung nóng gấp 3 lần áp suất trong bình sau khi nung. Đốt cháy một lượng Y, thu được 8,8 gam CO2 và 5,4 gam nước. Công thức phân tử của X là A. C2H2 B. C2H4 C. C4H6. D. C3H4.
Đọc tiếp
Trong bình kín chứa hidrocacbon X và hidro. Nung nóng bình đến khi phản ứng xảy ra hoàn toàn thu được khí Y duy nhất. Ở cùng nhiệt độ, áp suất trong bình trước khi nung nóng gấp 3 lần áp suất trong bình sau khi nung. Đốt cháy một lượng Y, thu được 8,8 gam CO2 và 5,4 gam nước. Công thức phân tử của X là
A. C2H2
B. C2H4
C. C4H6.
D. C3H4.
Đáp án A
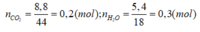
Gọi CTPT của H-C là: CnH2n+2-2k
CnH2n+2-2k + kH2 → CnH2n+2
0,1 ← 0,1k ← 0,1 (mol)
nCnH2n+2 = nH2O – nCO2 = 0,3 – 0,2 = 0,1 (mol)
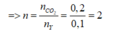
=> CTPT của Y là C2H6
Vì khối lượng trước phản ứng và sau phản ứng không thay đổi
![]()
Vậy CTPT của X là: C2H2
Đúng 0
Bình luận (0)
Đốt cháy hoàn toàn 10 ml hơi một este X cần vừa đủ 50 ml khí O2, thu được hỗn hợp Y gồm khí CO2 và hơi H2O có tỉ lệ thể tích tương ứng là 5 : 4. Ngưng tụ toàn bộ hơi H2O trong Y, thấy còn lại 50 mL khí. Biết các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất. Phân tử khối của X là A. 86 B. 100 C. 132 D. 118
Đọc tiếp
Đốt cháy hoàn toàn 10 ml hơi một este X cần vừa đủ 50 ml khí O2, thu được hỗn hợp Y gồm khí CO2 và hơi H2O có tỉ lệ thể tích tương ứng là 5 : 4. Ngưng tụ toàn bộ hơi H2O trong Y, thấy còn lại 50 mL khí. Biết các thể tích khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất. Phân tử khối của X là
A. 86
B. 100
C. 132
D. 118
Chọn đáp án C
50 mL khí không bị ngưng tụ là C O 2 ; tỉ lệ n H 2 O : n C O 2 = 4 : 5
→ có 40 mL H 2 O
các khí và hơi đo ở cùng điều kiện nhiệt độ, áp suất → chọn điều kiện V = 10 mL ⇄ 1 mol.
Ta có: đốt 1 mol este X cần 5 m o l O 2 → t 0 5 m o l C O 2 + 4 m o l H 2 O
BTNT oxi có trong X: n O = 4
→ số O = 4 : 1 = 4.
Lại có số C = 5 : 1 = 5 và số H = 4 × 2 : 1 = 8
→ CTPT của X là C 5 H 8 O 4
Tính được MX = 132
Đúng 0
Bình luận (0)
. Cho 560 ml hỗn hợp X đi qua ống chứa bột Ni nung nóng thu được 448 ml hỗn hợp khí X1. Cho X1 lội qua nước brom thấy nước brom bị nhạt màu một phần và khối lượng bình nước brom tăng thêm 0,345 gam. Hỗn hợp khí X2 ra khỏi bình nước brom có thể tích 280 ml và có tỉ khối hơi so với không khí là 1,283. Giả thiết các phản ứng đều xảy ra hoàn toàn, các olefin đều phản ứng với tốc độ như nhau và các khí cùng đo ở đktc. Công thức phân tử của ankan, của hai anken và % thể tích mỗi khí trong hỗn hợp X lầ...
Đọc tiếp
. Cho 560 ml hỗn hợp X đi qua ống chứa bột Ni nung nóng thu được 448 ml hỗn hợp khí X1. Cho X1 lội qua nước brom thấy nước brom bị nhạt màu một phần và khối lượng bình nước brom tăng thêm 0,345 gam. Hỗn hợp khí X2 ra khỏi bình nước brom có thể tích 280 ml và có tỉ khối hơi so với không khí là 1,283. Giả thiết các phản ứng đều xảy ra hoàn toàn, các olefin đều phản ứng với tốc độ như nhau và các khí cùng đo ở đktc. Công thức phân tử của ankan, của hai anken và % thể tích mỗi khí trong hỗn hợp X lần lượt là
A. C2H6 30%; C3H6 35,71%; C4H8 14,29%
B. C2H6 40%; C3H6 25,71%; C4H8 7,29%
C. C3H8 25%; C2H4 33,19%; C3H6 21,81%
D. C3H8 35%; C2H4 23,19%; C3H6 15,81%
Đáp án A
X1 gồm
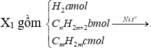
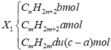
Vì X1 làm nhạt màu Br2 → CmH2m dư.
nX1 = 0,02 mol → nH2 = 0,025 - 0,02 = 0,005 mol.
mbình Br2 tăng = mCmH2m dư = 0,345 gam.
A2 gồm CnH2n + 2: b mol; CmH2m + 2: a mol.
nX2 = 0,0125 mol; MX2 = 1,283 x 29 = 37,2.
Trong X2 có b = 0,0125 - 0,005 = 0,0075 mol.
a + b + c = 0,025 → c = 0,0125 mol.
CmH2mdu = c - a = 0,0075
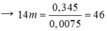
→ m = 3,3 → C3H6 và C4H8.
Theo BTKL:
mX = mX1 = mA2 + manken dư
= 37,2 x 0,0125 + 0,345 = 0,81 gam.
Trong X: mH2 = 2 x 0,005 = 0,01 mol
→ mCmH2m = 14m x c = 0,575 mol
→ mCnH2n + 2 = 0,225 gam.
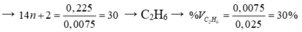
Đúng 0
Bình luận (0)
A là hiđrocacbon mạch hở, thể khí ở điều kiện thường. Khi đốt cháy hoàn toàn A bằng khí oxi (vừa đủ) thấy thể tích khí và hơi của các sản phẩm bằng tổng thể tích các khí tham gia phản ứng (thể tích các khí và hơi đều đo ở cùng điều kiện nhiệt độ và áp suất). Xác định công thức phân tử, công thức cấu tạo của A.
Pt:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
1 → (x + 0,25y) x 0,5y
Thể tích và số mol tỉ lệ thuận nên thể tích bằng nhau thì số mol cũng bằng nhau
Theo đề bài: n(khí trước pứ) = n(khí sau pứ)
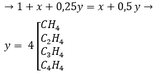
Đúng 0
Bình luận (0)
1. Trong bình đốt khí người ta dung tia lửa điện để đốt một hỗn hợp gồm60 cm3 gồm khí hiđro và khí oxi. a) Sau phản ứng còn thừa khí nào không? Thừa bao nhiêu cm3?b) Tính thể tích và khối lượng hơi nước thu được? (Biết các thể tích khí và hơi đo ở đktc).2. Để hòa tan hoàn toàn 4 gam hỗn hợp A gồm oxit của Đồng (II) và Sắt (III) cần vừa đủ 25,55 gam dung dịch HCl 20%.a) Tính khối lượng từng chất trong hỗn hợp A.b) Nếu đem hỗn hợp A nung nóng trong ống sứ rồi dẫn khí CO đi qua, trong điều kiện thí...
Đọc tiếp
1. Trong bình đốt khí người ta dung tia lửa điện để đốt một hỗn hợp gồm60 cm3 gồm khí hiđro và khí oxi.
a) Sau phản ứng còn thừa khí nào không? Thừa bao nhiêu cm3?
b) Tính thể tích và khối lượng hơi nước thu được? (Biết các thể tích khí và hơi đo ở đktc).
2. Để hòa tan hoàn toàn 4 gam hỗn hợp A gồm oxit của Đồng (II) và Sắt (III) cần vừa đủ 25,55 gam dung dịch HCl 20%.
a) Tính khối lượng từng chất trong hỗn hợp A.
b) Nếu đem hỗn hợp A nung nóng trong ống sứ rồi dẫn khí CO đi qua, trong điều kiện thí nghiệm thấy cứ 4 phân tử chất rắn mỗi loại tham gia phản ứng thì có 1 phân tử không tham gia phản ứng. Xác định thành phần và khối lượng chất rắn thu được sau phản ứng trong ống sứ?
Làm thế nào để:
-Tính được số nguyên tử, số phân tử của các chất trong một mẫu chất có khối lượng, thể tích cho trước:
-Tính được thể tích chủa một lượng khí(mà ko phải đo)
-So sánh được khối lượng của cùng một thể tích của 2 khí ở cùng điều kiện về nhiệt độ, áp suất(mà ko phải cân)
a, tính số mol rồi lấy số mol.6.1023
b, V=n.22,4
c d\(\frac{A}{B}\) = \(\frac{M_A}{M_B}\)
Đúng 0
Bình luận (0)
-Lấy số mol nhân cho 6.1023
-Lấy số mol nhân cho 22,4(ở đktc)
-\(d_{A/B}=\dfrac{M_A}{M_B}\)
Chúc bạn học tốt![]()
Đúng 0
Bình luận (0)
Làm thế nào để :
- Tính được số nguyên tử, số phân tử các chất trong một mẫu chất có khối lượng, thể tích cho trước.
- Tính được thể tích của một khối lượng khí ( mà không phải đo )
- So sánh được khối lượng của cùng mto56 thể tích của 2 khí ở cùng điều kiện về nhiệt độ, áp suất ( mà không phải cân )
-Lấy số mol nhân cho 6.1023
-Lấy số mol nhân cho 22,4(ở đktc)
-\(d_{A/B}=\dfrac{M_A}{M_B}\)
Chúc bạn học tốt![]()
Đúng 0
Bình luận (0)
Một lượng khí ở áp suất 3.10 5 Pa có thể tích 8 lít. Sau khi đun nóng đẳng áp khí nở ra và có thể tích 10 lít.
a. Tính công khí thực hiện được.
b. Tính độ biến thiên nội năng của khí, biết trong khi đun nóng khí nhận được nhiệt lượng 1000J
a.Ta có
![]()
Công khí thực hiện được
![]()
b. Độ biến thiên nội năng của khí :
![]()
Đúng 0
Bình luận (0)










