chất khí ở áp suất 5 bar nhiệt độ 10°C.Tính áp suất chất khí ở 30°C

Những câu hỏi liên quan
Một bình chứa một lượng khí ở nhiệt độ 30 độ C và áp suất 2 bar ( 1 bar = 105 Pa ) . Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi.
Ta có : T1 = toC + 273 = 30 + 273 = 303oK
p1 = 2 bar = 2 . 105 Pa
p2 = 4 bar = 4 . 105
Vì quá trình là đẳng tích , áp dụng định luật Charles ta có
\(\frac{p_1}{p_2}=\frac{T_1}{T_2}\)→ T2 = \(\frac{p_2.T_1}{p_1}=\frac{4.10^5.303}{2.10^5}\)= 606oK
Vậy để áp suất tăng lên gấp đôi , ta phải tăng nhiệt độ lên 606oK
Đúng 0
Bình luận (0)
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\frac{P1}{T1}=\frac{P2}{T2}\Rightarrow T2=\frac{P2.T1}{P1}=\frac{2P1.T1}{P1}\) = 2T1 = 606 K
Đúng 0
Bình luận (1)
một lượng chứa một lượng khí ở nhiệt độ 30oC và áp suất 2 bar . (1 bar = 105 Pa) . Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi ?
t = 30*C => T = 303K
Quá trình đẳng tích thì áp suất tỉ lệ thuận với nhiệt độ.
Áp suất tăng gấp đôi thì nhiệt độ tăng gấp đôi => T' = 2T = 606K
=> t' = 606 - 273 = 333*C
Đúng 0
Bình luận (0)
Một bình chứa một lượng khí ở nhiệt độ 30oC và áp suất 2 bar. (1 bar = 105 Pa). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi?
Bài giải:
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{p_2.T_1}{p_1}=\dfrac{2p_1.T_1}{p_1}=2T_1=606k\)
Đúng 0
Bình luận (0)
Một bình chứa một lượng khí ở nhiệt độ
30
°
C
và áp suất 2 bar. (
1
b
a
r
10
5
P
a
). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi ? Xem thể tích bình chứa luôn không đổi. A.
333
°
C
B.
606
°
C
C....
Đọc tiếp
Một bình chứa một lượng khí ở nhiệt độ 30 ° C và áp suất 2 bar. ( 1 b a r = 10 5 P a ). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi ? Xem thể tích bình chứa luôn không đổi.
A. 333 ° C
B. 606 ° C
C. 60 ° C
D. 303 ° C
+ Ta có:
![]()
+ Vì bình chứa có thể tích không đổi nên theo định luật Sác-lơ (quá trình đẳng tích) ta có:
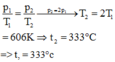
=> Chọn A.
Đúng 0
Bình luận (0)
Ở nhiệt độ
T
1
, áp suất
p
1
, khối lượng riêng của một chất khí là
ρ
1
.Lập biểu thức của khối lượng riêng của chất khí đó ở nhiệt độ
T
2
, áp suất
p
2
.
Đọc tiếp
Ở nhiệt độ T 1 , áp suất p 1 , khối lượng riêng của một chất khí là ρ 1 .
Lập biểu thức của khối lượng riêng của chất khí đó ở nhiệt độ T 2 , áp suất p 2 .
Một bình chứa một lượng khí ở nhiệt độ 30o C và áp suất 2 bar. (1 bar = 105 Pa). Hỏi phải tăng nhiệt độ lên tới bao nhiêu độ để áp suất tăng gấp đôi?
Trạng thái 1: T1 = t1 + 273 = 303 K; P1 = 2 bar
Trạng thái 2: P2 = 4 bar ; T2 = ?
Áp dụng định luật Sác-lơ cho quá trình biến đổi đẳng tích, ta có:
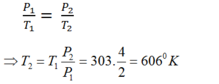
Đúng 1
Bình luận (0)
Biết thể tích của một lượng khí không đổi .
a Chất khí ở 0 độ C có áp suất 5atm . Tính áp suất của nó ở 137 độ C
b Chất khí ở 0 độ C có áp suất p0 , cần đun nóng chất khí lên bao nhiêu độ để áp suất nó tăng lên 4 lần
\(a,\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow p_2=\dfrac{p_1T_2}{T_1}\approx7,5atm\\ b,T_2=\dfrac{273.4p_o}{p_o}=1092^oK\Rightarrow t=819^oC\)
Đúng 1
Bình luận (0)
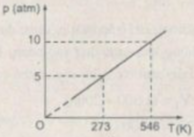
Biết thể tích của một lượng khí là không đổi. Hãy giải bài toán sau đây bằng hai cách: dùng công thức; dùng đồ thị. Chất khí ở 0 ° C có áp suất 5 atm. Tìm áp suất của khí ở nhiệt độ 273 ° C.
1 chất khí lí tưởng ở trạng thái 1 có áp suất P1=2atm. Thể tích V1=30lít, nhiệt độ t1=27*C. Người ta nén đẳng nhiệt thể tích giảm xuống còn 20lít. Tính áp suất chất khí sau khi nén
Tóm tắt:P1=2atm P2=?
V1=30l V2=20l
T1=T2
Áp dụng công thức Bôi lơ Ma ri ôt ta có:
P1.V1=P2.V2⇒P2=P1.V1:V2=2.30:20=3(atm)
Đúng 0
Bình luận (0)
Biết thể tích của một lượng khí không đổi.a) Chất khí ở
0
o
C
có áp suất 5atm. Tính áp suất của nó ở
137
o
C
.b) Chất khí ở
0
o
C
có áp suất
p
o
, cần đun nóng chất khí lên bao nhiêu độ để áp suất của nó tăng lên 4 lần?
Đọc tiếp
Biết thể tích của một lượng khí không đổi.
a) Chất khí ở 0 o C có áp suất 5atm. Tính áp suất của nó ở 137 o C .
b) Chất khí ở 0 o C có áp suất p o , cần đun nóng chất khí lên bao nhiêu độ để áp suất của nó tăng lên 4 lần?
a) Quá trình đẳng tích nên:
p 2 p 1 = T 2 T 1 ⇒ P 2 = p 1 . T 2 T 1
= 5. ( 273 + 137 ) 273 = 7 , 5 a t m .
b) Từ p o T o = p T ⇒ T = p p o T o
với p = 4 p o , T o = 273 o K
Suy ra: T = 4.273 = 1092 o K
h a y t = 1092 − 273 = 819 o C
Đúng 0
Bình luận (0)